
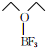 )的熔點為-58℃,沸點為126~129℃,它屬于分子晶體.
)的熔點為-58℃,沸點為126~129℃,它屬于分子晶體. 分析 (1)原子核外沒有運動狀態相同的電子;F原子核外電子排布為1s22s22p5,氟原子含有s和p兩種類型的軌道;
(2)NaHF2(氟化氫鈉)電解可制氟氣,說明NaHF2屬于離子化合物,F與H原子之間形成共價鍵,F的電負性較強,還存在氫鍵;
原子數目相等、價電子總數(或電子總數)相等的微粒互為等電子體;
(3)C2F4分子為F2C=CF2,C原子形成3個σ鍵、沒有孤對電子;
(4)三氟化硼乙醚的熔點、沸點比較低,屬于分子晶體.
解答 解:(1)原子核外沒有運動狀態相同的電子,基態氟原子核外含有9個電子,則其核外電子的運動狀態有9種;F原子核外電子排布為1s22s22p5,核外含有s軌道和p軌道兩種軌道,則氟原子的電子的電子云形狀有2種,氟原子的外圍含有7個電子,其外圍電子排布式為:2s22p5,
故答案為:9;2;2s22p5;
(2)NaHF2(氟化氫鈉)電解可制氟氣,說明NaHF2屬于離子化合物,F與H原子之間形成共價鍵,F的電負性較強,還存在氫鍵;
與HF2-互為等電子體的分子有CO2(或N2O),
故答案為:離子鍵、共價鍵、氫鍵;CO2(或N2O);
(3)C2F4分子為F2C=CF2,C原子形成3個σ鍵、沒有孤對電子,則其雜化軌道類型為sp2,
故答案為:sp2;
(4)三氟化硼乙醚的熔點為-58℃,沸點為126~129℃,其熔沸點比較低,應該屬于分子晶體,
故答案為:分子.
點評 本題是對物質結構的考查,涉及核外電子排布、電子云、化學鍵、等電子體、原子軌道雜化方式及晶體類型與性質等知識,注意掌握原子核外電子排布規律及原子軌道雜化類型的判斷方法,(2)中作用力判斷為易錯點,學生容易忽略氫鍵.


 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案 暑假作業安徽少年兒童出版社系列答案
暑假作業安徽少年兒童出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用食醋除去暖水瓶中的薄層水垢 | B. | 石油的分餾和煤的干餾 | ||
| C. | 用二氧化氯(ClO2)為自來水消毒 | D. | 液氨作制冷劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在標準狀況下,22.4L水所含分子數目為NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+數目為2NA | |
| C. | 1mol鈉與氧氣反應生成Na2O或Na2O2時,失電子數目均為NA | |
| D. | O2的摩爾體積約為22.4L.mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
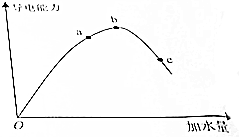 在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力如圖所示,請回答:
在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力如圖所示,請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀硝酸中加入過量鐵粉:Fe+4H++NO${\;}_{3}^{-}$═Fe3++NO↑+2H2O | |
| B. | 向NH4HSO4溶液中逐滴滴入Ba(OH)2溶液至恰好沉淀完全2OH-+Ba2++2H++SO${\;}_{4}^{2-}$═2H2O+BaSO4↓ | |
| C. | 向亞硫酸鋇固體中加入稀硝酸:3BaSO3+2H++2NO${\;}_{3}^{-}$═3BaSO4↓+2NO↑+H2O | |
| D. | 向Ca(ClO)2溶液中通入足量CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com