
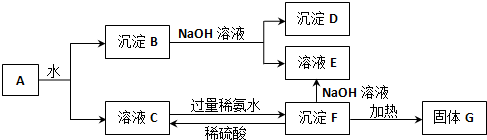
分析 某混合物A含有Al2(SO4)3、Al2O3和Fe2O3,將A溶于水,Al2(SO4)3溶于水,Al2O3和Fe2O3不溶于水,分離難溶性固體和溶液采用過濾方法,得到的濾液C中含有Al2(SO4)3,濾渣B為Al2O3和Fe2O3,向B中加入NaOH溶液,發生反應Al2O3+2NaOH=2NaAlO2+H2O,Fe2O3和NaOH不反應,過濾得到濾渣D為Fe2O3,濾液E中含有NaAlO2,向硫酸鋁溶液中加入過量氨水得到沉淀F為Al(OH)3,加熱分解得到的G為Al2O3,結合對應物質的性質以及題目要求解答該題.
解答 解:某混合物A含有Al2(SO4)3、Al2O3和Fe2O3,將A溶于水,Al2(SO4)3溶于水,Al2O3和Fe2O3不溶于水,分離難溶性固體和溶液采用過濾方法,得到的濾液C中含有Al2(SO4)3,濾渣B為Al2O3和Fe2O3,向B中加入NaOH溶液,發生反應Al2O3+2NaOH=2NaAlO2+H2O,Fe2O3和NaOH不反應,過濾得到濾渣D為Fe2O3,濾液E中含有NaAlO2,向硫酸鋁溶液中加入過量氨水得到沉淀F為Al(OH)3,加熱分解得到的G為Al2O3,
(1)可通過過濾的方法分離沉淀B與溶液C,故答案為:過濾;
(2)由以上分析可知,D為Fe2O3,E為NaAlO2,F為Al(OH)3,G為Al2O3,故答案為:Fe2O3;NaAlO2;Al(OH)3;Al2O3;
(3)濾渣B為Al2O3和Fe2O3,向B中加入NaOH溶液,發生反應Al2O3+2NaOH=2NaAlO2+H2O,離子方程式為Al2O3 +2OH-=2AlO2-+H2O,
F為Al(OH)3,與稀硫酸反應生成硫酸鋁,反應的離子方程式為Al(OH)3 +3H+=Al3++3H2O,
濾液C中含有Al2(SO4)3,加入氨水生成氫氧化鋁,反應的離子方程式為Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案為:Al2O3 +2OH-=2AlO2-+H2O;Al(OH)3 +3H+=Al3++3H2O;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)檢驗溶液中是否含有Fe3+,需用的試劑是KSCN,發生絡合反應,溶液變為血紅色,故答案為:KSCN溶液;溶液變為血紅色.
點評 本題考查混合物的分離和提純,為高頻考點,明確物質的性質是解本題關鍵,知道每個過程發生的反應及溶液中的溶質、沉淀成分,知道常見物質分離提純方法,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 100mL 0.5mol•L-1 HCl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)某氣態有機物X含C、H、O三種元素,已知下列條件,現欲確定X的分子式,所需的最少條件組合是①②④.(填相應的數字序號)
(1)某氣態有機物X含C、H、O三種元素,已知下列條件,現欲確定X的分子式,所需的最少條件組合是①②④.(填相應的數字序號)查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 二氧化硫能使浸過酸性高錳酸鉀溶液的濾紙褪色說明二氧化硫具有漂白性 | |
| B. | 將收集滿二氧化氮氣體的試管倒立在水中,水會充滿試管 | |
| C. | 氨氣可以做噴泉實驗,這是利用氨氣極易溶于水的性質 | |
| D. | 在實驗室中,不能利用稀硝酸與鋅粒反應制氫氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 胃酸過多的病人,可以服用氫氧化鈉來中和胃酸 | |
| B. | 晶體硅是在通信工程中制作光導纖維的主要原料 | |
| C. | 常溫下干燥的Cl2能用鋼瓶貯存 | |
| D. | 二氧化硅與氫氟酸的反應原理可用來雕刻玻璃 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的量濃度C(甲)=C(乙) | |
| B. | 甲中由水電離產生的H+的物質的量濃度是乙的0.1倍 | |
| C. | 中和等物質的量濃度等體積的NaOH溶液需甲、乙兩酸的體積V(乙)=10V(甲) | |
| D. | 甲中的C(OH-)為乙中C(OH-)的10倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①>③>② | B. | ②>③>① | C. | ③>②>① | D. | ①>②>③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com