
| A. | 原子半徑和簡單離子半徑減小 | |
| B. | 氧化物對應的水化物堿性減弱,酸性增強 | |
| C. | 14號元素的高純單質可制光電池 | |
| D. | 單質的熔點降低 |
分析 A、隨著原子序數的遞增,原子半徑逐漸減小,而離子半徑陰離子大于陽離子,且陰離子、陽離子中原子序數大的離子半徑小;
B、必須是最高價氧化物對應的水化物,不是最高價,不一定滿足;
C、14號元素是硅,是半導體材料;
D、金屬單質的熔點降低,而非金屬單質中,原子晶體沸點大于金屬晶體,分子晶體沸點較低.
解答 解:A、隨著原子序數的遞增,原子半徑逐漸減小,而離子半徑陰離子大于陽離子,且陰離子、陽離子中原子序數大的離子半徑小,故A錯誤;
B、必須指出是最高價氧化物對應的水化物的堿性減弱,酸性增強,否則不一定成立,故B錯誤;
C、14號元素是硅,是半導體材料,所以高純單質硅可制光電池,故C正確;
D、金屬單質的熔點降低,Si單質為原子晶體,則單質熔點大小為:Na<Mg<Al<Si(原子晶體),其它非金屬單質P、S、Cl2為分子晶體,熔點比金屬單質低,故整體趨勢為:Si>Al>Mg>S>P>Na>Cl2,故D錯誤;
故選C.
點評 本題考查了原子結構與元素周期律的關系,題目難度中等,明確元素周期律的內容為解答關鍵,注意熟練掌握原子結構與元素周期律、元素周期表的關系,B為易錯點,注意必須是最高價氧化物對應的水化物.


 新思維寒假作業系列答案
新思維寒假作業系列答案科目:高中化學 來源: 題型:解答題
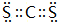 ,Y3-的立體構型為直線形.
,Y3-的立體構型為直線形.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
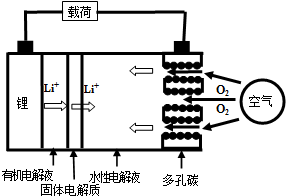
| A. | 放電時負極的電極反應式為:Li-e-=Li+ | |
| B. | 熔融的氫氧化鋰用惰性電極電解再生時,金屬鋰在陰極得到 | |
| C. | 有機電解液可以是乙醇等無水有機物 | |
| D. | 放電時,正極的電極反應式為:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (3m+n)mol | B. | (3m+n+2p)mol | C. | (2.5m+0.5n-3p)mol | D. | (2.5m+0.5n)mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,2.24LCHCl3含有的分子數為0.1NA | |
| B. | 0.1molCmH2n+2中含有的碳碳單鍵數為0.1nNA | |
| C. | 2.8g乙烯和丙烯的混合氣體中所含碳原子為0.2NA | |
| D. | 1mol苯乙烯中含有的碳碳雙鍵數為4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋁粉與燒堿溶液反應:Al+6OH+═[Al(OH)4]-+H2↑ | |
| B. | 水玻璃中加入稀鹽酸:Na2SiO4+2H+═H2SiO3↓+2Na+ | |
| C. | 二氧化硅與苛性鈉溶液反應:SiO2+2OH-═SiO32-+H2O | |
| D. | 將氯氣通入到水中:Cl2+H2O═2HCl-+ClO- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+H2O$\stackrel{催化劑}{→}$CH3CH2OH | ||
| C. | 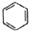 +HNO3$→_{50-60℃}^{濃硫酸}$ +HNO3$→_{50-60℃}^{濃硫酸}$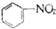 +H2O +H2O | D. | nCH2=CH2$\stackrel{一定條件}{→}$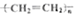 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 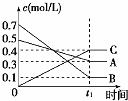 表示反應的方程式為5A(g)+7B(g)?4C(g) | |
| B. | 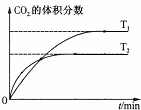 表示反應5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0 | |
| C. | 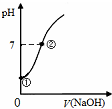 表示向飽和氯水中逐滴滴入0.1mol•L-1的氫氧化鈉溶液的pH 變化,①到②水的電離程度逐漸減小 | |
| D. | 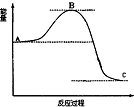 表示4H2(g)+2NO2(g)=N2(g)+4H2O(g)反應過程的能量變化,加入催化劑,將使C 點降低 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com