
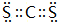 ,Y3-的立體構型為直線形.
,Y3-的立體構型為直線形.分析 X、Y、Z、W、Q五種前30號元素,原子序數依次增大,X、Y、Z、W均為非金屬元素,元素W與元素Z同主族,則W位于第三周期、Z位于第二周期,W能形成二價陰離子,則W是S元素、Z是O元素;
X的最外層有兩個未成對電子,且原子序數小于Z,則X是C元素、Y是O元素;
Q的基態原子中有5個未成對電子且Q的次外層電子數等于Y和W2-最外層電子數之和,則Q是Mn元素,
(1)元素的非金屬性越強,其電負性越大;Y是N元素、Z是氧元素,原子軌道中電子處于半滿、全滿或全空時最穩定;
(2)CS2為直線型分子,每個S原子和C原子形成兩個共用電子對;
根據價層電子對互斥理論判斷Y3-的立體構型;
(3)Q是Mn元素,其3d、4s能級上電子為其價電子;該元素位于d區;
(4)S與O組成最高價分子是SO3,該分子中S原子價層電子對個數是3且不含孤電子對;
(5)α型MnS的晶胞中陰陽離子的配位數均為6,其晶胞結構和氯化鈉相似,則與Q離子距離最近且距離相等的Q離子個數=3×8×$\frac{1}{2}$;
(6)α型MnS的晶胞是立方體,該物質一個晶胞中陰離子總數=$\frac{ρV{N}_{A}}{M}$,陰陽離子個數相等,離子總數是陰離子的2倍.
解答 解:X、Y、Z、W、Q五種前30號元素,原子序數依次增大,X、Y、Z、W均為非金屬元素,元素W與元素Z同主族,則W位于第三周期、Z位于第二周期,W能形成二價陰離子,則W是S元素、Z是O元素;
X的最外層有兩個未成對電子,且原子序數小于Z,則X是C元素、Y是O元素;
Q的基態原子中有5個未成對電子且Q的次外層電子數等于Y和W2-最外層電子數之和,則Q是Mn元素,
(1)元素的非金屬性越強,其電負性越大,這幾種元素非金屬性最強的是O元素,則電負性最大的是O元素;Y是N元素、Z是氧元素,原子軌道中電子處于半滿、全滿或全空時最穩定,N原子電子處于半滿狀態,所以N元素第一電離能大于O元素,
故答案為:O;N原子3p軌道半充滿,相對穩定;
(2)CS2為直線型分子,每個S原子和C原子形成兩個共用電子對,電子式為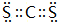 ;
;
N3-中中心N原子價層電子對個數是2,且不含孤電子對,所以為直線形結構,
故答案為: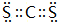 ;直線形;
;直線形;
(3)Q是Mn元素,其3d、4s能級上電子為其價電子,價電子排布式為3d54s2;該元素位于d區,
故答案為:3d54s2;d;
(4)S與O組成最高價分子是SO3,該分子中S原子價層電子對個數是3且不含孤電子對,為sp2雜化,
故答案為:sp2;
(5)α型MnS的晶胞中陰陽離子的配位數均為6,其晶胞結構和氯化鈉相似,則與Q離子距離最近且距離相等的Q離子個數=3×8×$\frac{1}{2}$=12,故答案為:12;
(6)α型MnS的晶胞是立方體,該物質一個晶胞中陰離子總數=$\frac{ρV{N}_{A}}{M}$=$\frac{ρ{a}^{3}{N}_{A}}{M}$,陰陽離子個數相等,離子總數是陰離子的2倍,所以離子總數為2$\frac{ρ{a}^{3}{N}_{A}}{M}$,
故答案為:2$\frac{ρ{a}^{3}{N}_{A}}{M}$.
點評 本題考查物質結構和性質,為高頻考點,把握均攤法、價層電子對互斥理論、原子核外電子排布等知識點即可解答,難點是(6)題晶胞計算,知道該晶胞中陰陽離子個數體系,題目難度中等.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | ③④⑤ | B. | ①②④ | C. | ②③ | D. | ①⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
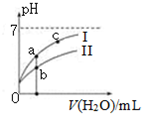 已知:下表為25℃時某些弱酸的電離平衡常數.
已知:下表為25℃時某些弱酸的電離平衡常數.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 相同濃度的CH3COONa和NaClO的混合溶液中,各離子濃度的大小關系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的離子方程式為:ClO-+CO2+H2O=HClO+CO32- | |
| C. | 圖象中a、c兩點處的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 圖象中a點酸的總濃度大于b點酸的總濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲醇是一種重要的化工原料.
甲醇是一種重要的化工原料.| CO2%-CO%-H2% (體積分數) | 0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | ||||||||
| 反應溫度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| 生成CH3OH的碳轉化率(%) | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 用Na2SO3溶液吸收硫酸工業尾氣中的二氧化硫,將所得的混合液進行電解循環再生,這種新工藝叫再生循環脫硫法.其中陰、陽離子交換膜組合循環再生機理如圖所示,則下列有關說法中不正確的是( )
用Na2SO3溶液吸收硫酸工業尾氣中的二氧化硫,將所得的混合液進行電解循環再生,這種新工藝叫再生循環脫硫法.其中陰、陽離子交換膜組合循環再生機理如圖所示,則下列有關說法中不正確的是( )| A. | X為直流電源的負極,Y為直流電源的正極 | |
| B. | 陽極區pH增大 | |
| C. | 圖中的b>a | |
| D. | 該過程中的產品還有H2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;
;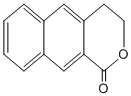 是一種重要的藥物合成中間體,請結合題目所給信息,
是一種重要的藥物合成中間體,請結合題目所給信息,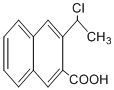 為原料制備該化合物的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:
為原料制備該化合物的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下: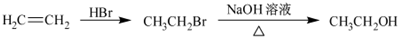
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能使甲基橙顯紅色的溶液中大量存在:Mg2+、Na+、Cl-、F- | |
| B. | 標準狀況下,46gNO2和N2O4混合氣體中含有原子個數為3NA | |
| C. | 1L0.5mol•L-1 CuSO4溶液中含有0.5NA個Cu2+ | |
| D. | 濃度均為0.1 mol/L的氨水和鹽酸、由水電離出的c(H+):鹽酸>氨水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C3H7Cl | B. | C3H6Cl2 | C. | C3H5Cl3 | D. | C3HCl7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑和簡單離子半徑減小 | |
| B. | 氧化物對應的水化物堿性減弱,酸性增強 | |
| C. | 14號元素的高純單質可制光電池 | |
| D. | 單質的熔點降低 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com