
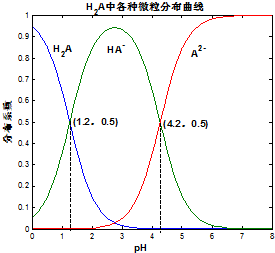
 常溫下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物質的量分數(分布系數)隨pH變化的關系如圖所示.下列表述不正確的是( )
常溫下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物質的量分數(分布系數)隨pH變化的關系如圖所示.下列表述不正確的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在 0.1mol/L NaHA溶液中,各離子濃度大小關系為:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃時HF的 Ka=10-3.45,將少量H2A的溶液加入足量NaF溶液中,發生的反應為:H2A+F-═HF+HA- | |
| D. | 將等物質的量的NaHA、Na2A溶于水中,所得溶液pH恰好為4.2 |
分析 由圖象可知,pH=1.2時,溶液中存在H2A、HA-,且二者濃度相等,說明H2A部分電離,電離方程式為H2A?H++HA-,則K1=$\frac{c({H}^{+})×c(H{A}^{-})}{c({H}_{2}A)}$=10-1.2,
pH=4.2時,HA-、A2-濃度相等,且二者濃度相等,電離方程式為HA-?H++A2-,則K2=$\frac{c({H}^{+})×c({A}^{2-})}{c(H{A}^{-})}$=10-4.2,以此解答該題.
解答 解:由圖象可知,pH=1.2時,溶液中存在H2A、HA-,且二者濃度相等,說明H2A部分電離,電離方程式為H2A?H++HA-,則K1=$\frac{c({H}^{+})×c(H{A}^{-})}{c({H}_{2}A)}$=10-1.2,
pH=4.2時,HA-、A2-濃度相等,且二者濃度相等,電離方程式為HA-?H++A2-,則K2=$\frac{c({H}^{+})×c({A}^{2-})}{c(H{A}^{-})}$=10-4.2,
A.H2A部分電離,分步電離,以第一步電離為主,則電離方程式為H2A?H++HA-,故A錯誤;
B.pH=4.2時,HA-、A2-濃度相等,溶液呈酸性,說明HA-電離程度大于HA-水解程度,則在0.1mo/LNaHA溶液中,各離子濃度大小關系為:c(Na+)>c(HA-)>c(H+),因還存在水的電離,則c(H+)>c(A2-)>c(OH-),所以各離子濃度大小關系為:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正確;
C.已知25℃時HF的Ka=10-3.45,由以上信息可知K1=$\frac{c({H}^{+})×c(H{A}^{-})}{c({H}_{2}A)}$=10-1.2,K2=$\frac{c({H}^{+})×c({A}^{2-})}{c(H{A}^{-})}$=10-4.2,則酸性H2A>HF>HA-,則將少量H2A的溶液加入足量的NaF溶液中,發生的反應為:H2A+F-═HF+HA-,故C正確;
D.HA-即能水解又能電離,A2-能水解,而且A2-的水解程度大于HA-的水解程度,故將相同物質的量的NaHA和Na2A固體溶于水后,HA-和A2-的濃度不再相等,無法計算溶液的pH,故D錯誤.
故選AD.
點評 本題考查了離子濃度大小比較,側重學生的分析、計算能力的考查,明確圖象中曲線變化的含義為解答關鍵,根據圖象掌握平衡常數的應用為解答該題的關鍵,難度中等.


 黎明文化寒假作業系列答案
黎明文化寒假作業系列答案 寒假天地重慶出版社系列答案
寒假天地重慶出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | Z單質還原性大于Y單質 | |
| B. | X的氫化物沸點高于W的氫化物 | |
| C. | 僅含X、Y兩元素的化合物均只含離子鍵 | |
| D. | 上述四種元素形成的簡單離子中,X離子半徑最小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
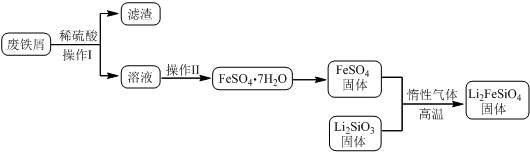
 某校化學興趣小組探究SO2與FeCl3溶液的反應,所用裝置如圖所示(夾持儀器已略去).
某校化學興趣小組探究SO2與FeCl3溶液的反應,所用裝置如圖所示(夾持儀器已略去).查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 從海水中提取溴、碘都涉及置換反應,從礦物質中獲取鋁、鐵、銅、硅都不涉及置換反應 | |
| B. | 利用溶解度數據可推測將一些混合物質分離開來的可能性,利用原子半徑數據可推測某些原子的氧化性和還原性的強弱 | |
| C. | 因為食鹽能使細菌變性,所以可以用食鹽水殺死H7N9禽流感病毒 | |
| D. | 某反應的△H>0、△S<0,則該反應一定不能正向進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
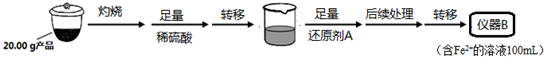
| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液體積 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
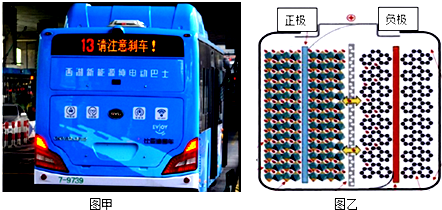
| A. | 充電時陽極反應可表示為LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| B. | 充電時陰極反應可表示為xLi++xe-+6C=LixC6 | |
| C. | 放電時負極反應可表示為LixC6-xe-=xLi++6C | |
| D. | 放電時Li+從左向右通過離子交換膜 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molC60F60分子中非極性共價鍵數目為60NA | |
| B. | 2.1gDTO分子中所含中子數為NA | |
| C. | 4.6gN2O4和NO2混合物中含的電子數為2.3NA | |
| D. | aml1mol/L的H2B溶液中,測得溶液中無H2B分子,則溶液中陰離子數為aNA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com