
分析 將3mol A和2.5mol B混合于2L的密閉容器中,5min后反應達到平衡狀態,容器內的壓強變小,則3+1>x+2,則x<2,故x=1,平衡時D的平均反應速率為0.1mol/(L•min),則生成D為0.1mol/(L•min)×5min×2L=1mol,則:
3A(g)+B(g)?C(g)+2D(g)
起始量(mol):3 2.5 0 0
轉化量(mol):1.5 0.5 0.5 1
平衡量(mol):1.5 2 0.5 1
(1)轉化率=$\frac{物質的量變化量}{起始物質的量}$×100%;
(2)恒溫恒容下,壓強之比等于氣體物質的量之比.
解答 解:將3mol A和2.5mol B混合于2L的密閉容器中,5min后反應達到平衡狀態,容器內的壓強變小,則3+1>x+2,則x<2,故x=1,平衡時D的平均反應速率為0.1mol/(L•min),則生成D為0.1mol/(L•min)×5min×2L=1mol,則:
3A(g)+B(g)?C(g)+2D(g)
起始量(mol):3 2.5 0 0
轉化量(mol):1.5 0.5 0.5 1
平衡量(mol):1.5 2 0.5 1
(1)平衡時B轉化率=$\frac{0.5mol}{2.5mol}$×100%=20%,故答案為:20%;
(2)恒溫恒容下,壓強之比等于氣體物質的量之比,則平衡時容器內的壓強與原容器內壓強的比值為(1.5+2+0.5+1)mol:(3+2.5)mol=10:11,故答案為:10:11.
點評 本題考查化學平衡計算,關鍵是確定C的系數,注意三段式解題法在化學平衡計算中應用.


 金鑰匙試卷系列答案
金鑰匙試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 80% | B. | 65% | C. | 45% | D. | 37% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱化學方程式中的化學計量數只表示物質的量,可以是分數 | |
| B. | △H>0表示放熱反應,△H<0表示吸熱反應 | |
| C. | 1 mol H2與0.5 mol O2反應放出的熱就是H2的燃燒熱 | |
| D. | 1 mol H2SO4與1 mol Ba(OH)2反應生成BaSO4沉淀時放出的熱叫做中和熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗小組用如圖所示的實驗裝置進行實驗.
實驗小組用如圖所示的實驗裝置進行實驗.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有①②④⑤ | B. | 只有③ | C. | 只有②③ | D. | 只有①④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由題給△H值可知,該反應是一個放熱反應 | |
| B. | △S>0表明該反應是一個熵增加的反應 | |
| C. | 該反應在室溫下可能自發 | |
| D. | 不能確定該反應能否自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
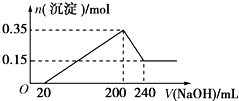 將一定質量的鎂鋁混合物投入200mL硫酸中,固體全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物質的量n與加入NaOH溶液的體積V的變化如圖所示.
將一定質量的鎂鋁混合物投入200mL硫酸中,固體全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物質的量n與加入NaOH溶液的體積V的變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{ρ}{400}$ | B. | $\frac{20}{ρ}$ | C. | 2.5 ρ | D. | 1.25 ρ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com