
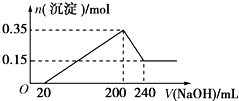
 將一定質量的鎂鋁混合物投入200mL硫酸中,固體全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物質的量n與加入NaOH溶液的體積V的變化如圖所示.
將一定質量的鎂鋁混合物投入200mL硫酸中,固體全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物質的量n與加入NaOH溶液的體積V的變化如圖所示.分析 (1)由圖象可知,從開始至加入NaOH溶液20mL,沒有沉淀生成,說明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此時發生的反應為:H2SO4+2NaOH=Na2SO4+2H2O;當V(NaOH溶液)=200mL時,沉淀量最大,此過程中鎂離子、鋁離子與氫氧根離子反應生成Mg(OH)2和Al(OH)3;從200mL到240mL,NaOH溶解Al(OH)3,據此寫出反應的離子方程式;
(2)根據沉淀的最大量可知氫氧化鎂和氫氧化鋁的總物質的量、最小量,最小量為氫氧化鎂,根據最大量可知氫氧化鋁的物質的量,然后利用質量守恒計算出鎂、鋁的物質的量,再根據m=nM計算出混合金屬的質量;
(3)溶液中溶質為Na2SO4,根據鈉元素守恒可知此時n(Na2SO4)等于200mL氫氧化鈉溶液中含有的n(NaOH)的0.5倍,據此計算硫酸的物質的量,進而計算濃度大小;
(4)根據以上分析,由元素守恒可知金屬鎂和鋁物質的量分別為0.15mol和0.2mol,又硫酸過量所以鎂鋁全部反應,根據得失電子守恒進行計算.
解答 解:(1)由圖象可知,從開始至加入NaOH溶液20mL,沒有沉淀生成,說明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此時發生的反應為:H2SO4+2NaOH=Na2SO4+2H2O,離子方程式為:OH-+H+=H2O;當V(NaOH溶液)=200mL時,沉淀量最大,此時為Mg(OH)2和Al(OH)3,發生反應為:Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3;從200mL到240mL,NaOH溶解Al(OH)3,反應的離子方程式為:Al(OH)3+OH-=AlO2-+2H2O,
故答案為:OH-+H+=H2O;Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(2)根據天下可知Mg(OH)2和Al(OH)3的物質的量之和為0.35mol,從200mL到240mL,NaOH溶解Al(OH)3,當V(NaOH溶液)=240mL時,沉淀不再減少,此時全部為Mg(OH)2,物質的量為0.15mol,所以沉淀量最大,Mg(OH)2為0.15mol,Al(OH)3為0.35mol-0.15mol=0.2mol,
由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,
所以鎂和鋁的總質量為0.2mol×27g/mol+0.15mol×24g/mol=9g,
故答案為:9;
(3)沉淀量最大時為Mg(OH)2和Al(OH)3,溶液中溶質為Na2SO4,根據鈉元素守恒可知此時n(Na2SO4)等于200mL氫氧化鈉溶液中含有的n(NaOH)的0.5倍,所以n(Na2SO4)=0.5×0.2L×5mol/L=0.5mol,所以硫酸的濃度為$\frac{0.5mol}{0.2L}$=2.5mol/L,
故答案為:2.5;
(4)根據以上分析,由元素守恒可知金屬鎂和鋁物質的量分別為0.15mol和0.2mol,根據得失電子守恒氫氣在標準狀況下的體積為:$\frac{0.15×2+0.2×3}{2}$×22.4L=10.08L,
故答案:10.08.
點評 本題考查鎂鋁的重要化合物及計算,為高頻考點,把握圖象各階段的物質的量的關系及各階段的化學反應為解答的關鍵,注意反應的先后順序及利用守恒計算,側重分析與計算能力的考查.


科目:高中化學 來源: 題型:填空題
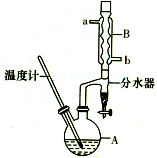 正丁醚常用作有機反應的溶劑.實驗室制備正丁醚的反應和主要實驗裝置如圖:
正丁醚常用作有機反應的溶劑.實驗室制備正丁醚的反應和主要實驗裝置如圖:| 相對分子質量 | 沸點/℃ | 密度/g/cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 幾乎不溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 目前工業合成氨的原理是:
目前工業合成氨的原理是:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對于可逆反應:H2(g)+Br2(g)?2HBr(g)達到化學平衡后,增大壓強時,混合氣體顏色變深 | |
| B. | 合成氨工業中溫度選擇為500°C | |
| C. | 配制Al2(SO4)3溶液時加入少量稀硫酸 | |
| D. | 合成氨工業采用循環操作,可提高原料利用率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+ Na+ Mn2+ S2- | B. | Na+ HCO3- Al3+ Cl- | ||
| C. | K+ Na+ Cl- S2- | D. | K+ Cl- Ba2+ OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
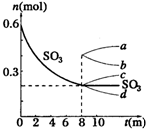 在一個2L的密閉容器中,發生反應2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的變化如圖所示:
在一個2L的密閉容器中,發生反應2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的變化如圖所示:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com