
重水(D2O)是重要的核工業原料,下列說法錯誤的是( )
A.氘(D)原子核外有1個電子
B.1H與D互稱同位素
C.H2O與D2O互稱同素異形體
D.1H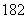 O與D
O與D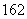 O的相對分子質量相同
O的相對分子質量相同
 星級口算天天練系列答案
星級口算天天練系列答案 芒果教輔達標測試卷系列答案
芒果教輔達標測試卷系列答案科目:高中化學 來源: 題型:
下列數據是對應物質的熔點:
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 801 | 1 291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2 073 | -57 | 1 723 |
據此作出的下列判斷中錯誤的是( )
A.鋁的化合物的晶體中有的是離子晶體 B.表中只有BCl3和干冰是分子晶體
C.同族元素的氧化物可形成不同類型的晶體 D.不同族元素的氧化物可形成相同類型的晶體
查看答案和解析>>
科目:高中化學 來源: 題型:
下列有關硫元素及其化合物的說法或描述正確的是( )
A.硫黃礦制備硫酸經歷兩步:S SO3
SO3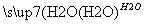 H2SO4
H2SO4
B.酸雨與土壤中的金屬氧化物反應后,硫元素以單質的形式進入土壤中
C.在燃煤中加入石灰石可減少SO2排放,發生的反應為2CaCO3+2SO2+O2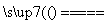 2CO2+2CaSO4
2CO2+2CaSO4
D.土壤中的閃鋅礦(ZnS)遇到硫酸銅溶液轉化為銅藍(CuS),說明CuS很穩定,不具有還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
按要求填空(均為短周期元素)
(1)最外層電子數為1的元素有______(填元素符號,下同)。
(2)最外層電子數為2的元素有______。
(3)最外層電子數與次外層電子數相等的元素有______。
(4)最外層電子數是次外層電子數2倍的元素是______。
(5)最外層電子數是次外層電子數3倍的元素是______。
(6)次外層電子數是最外層電子數2倍的元素有______。
(7)內層電子總數是最外層電子數2倍的元素有______。
(8)電子層數與最外層電子數相等的元素有______。
(9)最外層電子數是電子層數2倍的元素有______。
(10)最外層電子數是電子層數3倍的元素有______。
查看答案和解析>>
科目:高中化學 來源: 題型:
已知A、B、C、D是中學化學中常見的四種不同粒子,它們之間存在如圖所示的轉化關系(反應條件已經略去):

(1)如果A、B、C、D均是10電子的粒子,請寫出A、D的電子式:A____________;D____________。
(2)如果A和C是18電子的粒子,B和D是10電子的粒子,請寫出:
①A與B在溶液中反應的離子方程式為__________________________________________。
②根據上述離子方程式,可以判斷C與B結合質子的能力大小是________________________________________________________________________
________________________________________________________________________
(用化學式或離子符號表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
A、B、C、D、E五種短周期元素,它們的原子序數依次增大;A元素的原子半徑最小;B元素的最高價氧化物對應水化物與其氫化物能生成鹽;D與A同主族,且與E同周期;E元素原子的最外層電子數是其次外層電子數的  ,A、B、D、E這四種元素,每一種與C元素都能形成元素的原子個數比不相同的若干種化合物。
,A、B、D、E這四種元素,每一種與C元素都能形成元素的原子個數比不相同的若干種化合物。
請回答下列問題:
(1)B單質的電子式是________。
(2)A、B、C、E可形成兩種酸式鹽(均由四種元素組成),兩種酸式鹽相互反應的離子方程式為____________________________。
(3)A、C、E間可形成甲、乙兩種微粒,它們均為負一價雙原子陰離子,且甲有18個電子,乙有10個電子,則甲與乙反應的離子方程式為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
在標準狀況下將1.92 g銅粉投入一定量濃HNO3中,隨著銅粉的溶解,反應生成的氣體顏色逐漸變淺,當銅粉完全溶解后共收集到由NO2和NO組成的混合氣體1.12 L,則反應消耗HNO3的物質的量為( )
A.0.8 mol B.0.6 mol
C.0.11 mol D.無法計算
查看答案和解析>>
科目:高中化學 來源: 題型:
廢棄物的綜合利用既有利于節約資源,又有利于保護環境。實驗室利用廢舊電池的銅帽(Cu、Zn總含量約為99%)回收Cu并制備ZnO的部分實驗過程如下:
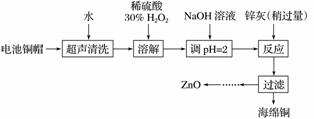
(1)①銅帽溶解時加入H2O2的目的是________________________________________________________________________
(用化學方程式表示)。
②銅帽溶解完全后,需將溶液中過量的H2O2除去。除去H2O2的簡便方法是________________________________________________________________________。
(3)已知pH>11時Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了幾種離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1.0 mol·L-1計算)。
| 開始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
實驗中可選用的試劑:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH。
由除去銅的濾液制備ZnO的實驗步驟依次為
①________________________________________________________________________;
②________________________________________________________________________;
③過濾;
④________________________________________________________________________;
⑤過濾、洗滌、干燥;
⑥900 ℃煅燒。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com