
下列數據是對應物質的熔點:
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 801 | 1 291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2 073 | -57 | 1 723 |
據此作出的下列判斷中錯誤的是( )
A.鋁的化合物的晶體中有的是離子晶體 B.表中只有BCl3和干冰是分子晶體
C.同族元素的氧化物可形成不同類型的晶體 D.不同族元素的氧化物可形成相同類型的晶體
 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:
用“偏大”、“偏小”或“無影響”填空
(1)配制450 mL 0.1 mol·L-1的NaOH溶液,用托盤天平稱取NaOH固體1.8 g________。
(2)配制500 mL 0.1 mol·L-1的硫酸銅溶液,用托盤天平稱取膽礬8.0 g________。
(3)配制NaOH溶液時,天平的兩個托盤上放兩張質量相等的紙片,其他操作均正確________。
(4)配制一定物質的量濃度的NaOH溶液,需稱量溶質4.4 g,稱量時物碼放置顛倒________。
(5)用量筒量取濃硫酸時,仰視讀數________。
(6)配制NaOH溶液時,將稱量好的NaOH固體放入小燒杯中溶解,未經冷卻立即轉移到容量瓶中并定容________。
(7)定容時,加水超過刻度線,用膠頭滴管吸取多余的液體至刻度線________。
(8)定容搖勻后,發現液面下降,繼續加水至刻度線________________________________________________________________________。
(9)定容時仰視刻度線________。
(10)定容搖勻后少量溶液外流________。
查看答案和解析>>
科目:高中化學 來源: 題型:
按照下列元素基態原子的電子排布特征判斷元素,并回答問題。
A的原子中只有一個電子層且只含1個電子;B的原子3p軌道上得到1個電子后不能再容納外來電子;C的原子的2p軌道上有1個電子的自旋方向與其他電子的自旋方向相反;D的原子第三電子層上有8個電子,第四電子層上只有1個電子;E原子的外圍電子排布式為3s23p6。
(1)寫出A、B、C、D四種元素的元素符號:________________________________。
(2)檢驗某溶液中是否含有D+,可通過________反應來實現;檢驗某溶液中是否含有B-,通常所用的試劑是__________和__________。
(3)寫出E的元素符號________,要證明太陽上是否含有E元素,可采用的方法是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
下列關于晶體的說法中,正確的是( )
A.在晶體中只要有陰離子就一定有陽離子 B.在晶體中只要有陽離子就一定有陰離子
C.原子晶體的熔點一定比金屬晶體的高 D.分子晶體的熔點一定比金屬晶體的低
查看答案和解析>>
科目:高中化學 來源: 題型:
如圖是某無機化合物的二聚分子,該分子中A、B兩種元素都是第3周期的元素,分子中所有原子的最外層電子數都達到8個電子的穩定結構。下列說法不正確的是( )

A.該化合物的化學式是Al2Cl6 B.該化合物是離子化合物,在熔融狀態下能導電
C.該化合物在固態時所形成的晶體是分子晶體 D.該化合物中不存在離子鍵,也不含有非極性共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
有A、B、C、D四種元素,其中A元素和B元素的原子都有1個未成對電子,A+比B-少一個電子層,B原子得一個電子后3p軌道全滿;C原子的p軌道中有3個未成對電子,其氣態氫化物在水中的溶解度在同族元素所形成的氫化物中最大;D的最高化合價和最低化合價的代數和為4,其最高價氧化物中含D的質量分數為40%,且其核內質子數等于中子數。R是由A、D兩元素形成的離子化合物,其中A與D離子數之比為2∶1。請回答下列問題:
(1)A單質、B單質、化合物R的熔點大小順序為下列的________(填序號)。
①A單質>B單質>R ②R>A單質>B單質
③B單質>R>A單質 ④A單質>R>B單質
(2)在CB3分子中C元素原子的原子軌道發生的是______雜化,其固體時的晶體類型為________。
(3)寫出D原子的核外電子排布式:______________________________。C的氫化物比D的氫化物在水中的溶解度大得多的可能原因是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
下列說法正確的是( )
A.因為SO2具有漂白性,所以它能使品紅溶液、溴水、酸性KMnO4溶液、石蕊溶液褪色
B.能使品紅溶液褪色的物質不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使紅墨水褪色,但原理不都相同
D.等物質的量的SO2和Cl2混合后通入裝有濕潤的有色布條的集氣瓶中,漂白效果更好
查看答案和解析>>
科目:高中化學 來源: 題型:
硫代硫酸鈉(Na2S2O3)可用做分析試劑及鞣革的還原劑,它受熱、遇酸易分解。工業上可用反應:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 制得。實驗室模擬該工業過程的裝置如圖所示。回答下列問題:
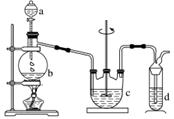
(1)b中反應的離子方程式為_______________________________________________________,
c中試劑為____________。
(2)反應開始后,c中先有渾濁產生,后又變澄清。此渾濁物是____________。
(3)d中的試劑為______________。
(4)實驗中要控制SO2生成速率,可以采取的措施有
________________________________________________________________________
__________________________________________________________(寫出兩條)。
(5)為了保證硫代硫酸鈉的產量,實驗中通入SO2不能過量,原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
重水(D2O)是重要的核工業原料,下列說法錯誤的是( )
A.氘(D)原子核外有1個電子
B.1H與D互稱同位素
C.H2O與D2O互稱同素異形體
D.1H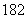 O與D
O與D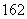 O的相對分子質量相同
O的相對分子質量相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com