

分析 (1)減少生成物濃度平衡正向移動;
(2)根據元素守恒知,X為二氧化碳,實驗室用澄清石灰水檢驗二氧化碳;
(3)Al和氯化鐵發生氧化還原反應生成氯化鋁和氯化亞鐵;
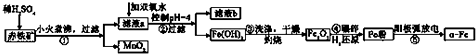
(4)鋁土礦加入過量NaOH可將SiO2、Al2O3溶解,Fe2O3不反應,然后過濾,濾液甲中含有NaAlO2、NaOH、Na2SiO3,甲中加入過量稀鹽酸,NaAlO2、NaOH、Na2SiO3和稀鹽酸反應后生成NaCl、AlCl3、H2SiO3,過濾后的溶液中含有NaCl、AlCl3、HCl,濾液乙中加入過量氨水,生成Al(OH)3沉淀和NH4Cl,過濾將氫氧化鋁灼燒得到Al2O3.
解答 解:(1)減少生成物濃度平衡正向移動,加入焦炭消耗反應生成的氧氣,使平衡向著正反應方向移動,故答案為:加入焦炭消耗反應生成的氧氣,使平衡向正反應方向移動;
(2)所生成的氣體X為CO2,檢驗方法為將氣體通入澄清石灰水中,若澄清石灰水變渾濁,則說明生成的氣體X為CO2,
故答案為:將氣體通入澄清石灰水中,若澄清石灰水變渾濁,則說明生成的氣體X為CO2;
(3)加入鋁粉,可將FeCl3還原為熔點較高的FeCl2.在提純時可避免AlCl3中混有FeCl3,化學方程式為Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2,
故答案為:Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2;
(4)鋁土礦加入過量NaOH可將SiO2、Al2O3溶解,Fe2O3不反應,然后過濾,濾液甲中含有NaAlO2、NaOH、Na2SiO3,甲中加入過量稀鹽酸,NaAlO2、NaOH、Na2SiO3和稀鹽酸反應后生成NaCl、AlCl3、H2SiO3,過濾后的溶液中含有NaCl、AlCl3、HCl,濾液乙中加入過量氨水,生成Al(OH)3沉淀和NH4Cl,過濾將氫氧化鋁灼燒得到Al2O3;
①鋁土礦中加入過量NaOH溶液,其中Al2O3和SiO2與NaOH反應,生成可溶的NaAlO2和Na2SiO3存在濾液甲中,還有未反應的NaOH,故答案為:NaOH、NaAlO2、Na2SiO3;
②濾液乙中加入過量氨水的離子方程式為Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案為:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
③工業上采取電解熔融Al2O3的方法獲得金屬鋁,化學方程式為2Al2O3(熔融)$\frac{\underline{\;電解\;}}{\;}$ 4Al+3O2↑,
故答案為:電解法;2Al2O3(熔融)$\frac{\underline{\;電解\;}}{\;}$ 4Al+3O2↑.
點評 本題考查物質制備,為高頻考點,涉及物質制備、物質分離和提純、金屬冶煉、物質檢驗等知識點,明確元素化合物性質、物質分離提純方法等知識點是解本題關鍵,注意:工業上用電解熔融氧化鋁的方法冶煉Al,不能用電解氯化鋁的方法冶煉Al,因為熔融狀態下氯化鋁不導電.


 輕松奪冠全能掌控卷系列答案
輕松奪冠全能掌控卷系列答案科目:高中化學 來源: 題型:解答題
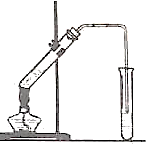 如圖,在左試管中先加入2mL95%的乙醇,并在搖動下緩緩加入3mL濃硫酸,再加入2mL乙酸,充分搖勻.在右試管中加入5mL飽和Na2CO3溶液.按圖連接好裝置,用酒精燈對左試管小火加熱3~5min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗.
如圖,在左試管中先加入2mL95%的乙醇,并在搖動下緩緩加入3mL濃硫酸,再加入2mL乙酸,充分搖勻.在右試管中加入5mL飽和Na2CO3溶液.按圖連接好裝置,用酒精燈對左試管小火加熱3~5min后,改用大火加熱,當觀察到右試管中有明顯現象時停止實驗.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應為可逆反應,不可能進行到底,即乙醇的轉化率一定達不到100% | |
| B. | 乙酸揮發,導致其量減少,乙醇過量,不能充分轉化為乙酸乙酯 | |
| C. | 產物不穩定,易被氧化為其他物質而影響乙醇的轉化率 | |
| D. | 餾出物導入飽和碳酸鈉溶液液面上,有較多的乙酸乙酯溶解于水溶液中 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.某學生在實驗室利用如圖的實驗裝置制備乙酸乙酯并研究其反應條件.
乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.某學生在實驗室利用如圖的實驗裝置制備乙酸乙酯并研究其反應條件.| 物質 | 沸點/°C | 密度/g?cm-3 |
| 乙醇 | 78.0 | 0.79 |
| 乙酸 | 117.9 | 1.05 |
| 乙酸乙酯 | 77.5 | 0.90 |
| 異戊醇 | 131 | 0.8123 |
| 乙酸異戊酯 | 142 | 0.8670 |
| 實驗編號 | 試管Ⅰ中的試劑 | 測得有機層的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L濃硫酸 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| NaOH溶液 | 銀氨溶液 | 新制Cu(OH)2 | 金屬鈉 | |
| A | 發生中和反應 | 不反應 | 溶解 | 生成氫氣 |
| B | 不反應 | 有銀鏡反應 | 有紅色沉淀 | 放出氫氣 |
| C | 發生水解反應 | 有銀鏡反應 | 有紅色沉淀 | 不反應 |
| D | 發生水解反應 | 不反應 | 不反應 | 不反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com