

分析 用含有Fe2O3 的鈦鐵礦(主要成分為FeTiO3 )為原料制備二氧化鈦:鈦鐵礦溶于酸生成亞鐵離子和TiO2+,反應的離子方程式為:FeTiO3+4H+=Fe2++TiO2++2H2O,步驟②中,用鐵粉將Fe3+轉化為Fe2+的反應的離子方程式為:2Fe3++Fe=3Fe2+,步驟③利用的是物質溶解度的不同,通過冷卻熱飽和溶液,冷卻結晶得到硫酸亞鐵晶體,④中使用熱水的目的是促進TiO2+水解生成H2TiO3,分離出固體加熱得到TiO2.
(1)堿性氧化物和酸反應生成鹽和水;
(2)金屬鐵可以和鐵離子反應生成亞鐵離子,結合電荷守恒、原子守恒配平寫出離子方程式;根據物質溶解度分析析出晶體的條件應用;
(3)TiO2+發生水解生成鈦酸(H2TiO3)沉淀,根據元素守恒寫出反應的離子方程式;
(4)依據二氧化錳的氧化性氧化亞鐵離子分析氧化還原反應生成二價錳的化合物,結合電荷守恒和原子守恒寫出;
(5)依據圖示生成物質的分析,陽極生成二氧化碳,陰極析出鈣,結合電解池中陽極發生氧化反應,陰極發生還原反應,寫出電極反應;根據電解槽中發生的反應:2CaO$\frac{\underline{\;電解\;}}{\;}$2Ca+O2↑以及鈣還原二氧化鈦反應方程式:2Ca+TiO2=Ti+2CaO來回答;
(6)根據鈦原子守恒進行解答.
解答 解:(1)氧化鐵和硫酸反應生成硫酸鐵和水,離子方程式為:Fe2O3+6H+=2Fe3++3H2O,
故答案為:Fe2O3+6H+=2Fe3++3H2O;
(2)用鐵粉將Fe3+轉化為Fe2+的反應的離子方程式為:2Fe3++Fe=3Fe2+,步驟③冷卻結晶得到硫酸亞鐵晶體,利用的是物質溶解度的不同,通過冷卻熱飽和溶液得到,
故答案為:2Fe3++Fe=3Fe2+;b;
(3)TiO2+發生水解生成鈦酸(H2TiO3)沉淀和氫離子,其離子方程式為:TiO2++2H2O═H2TiO3↓+2H+,
故答案為:TiO2++2H2O═H2TiO3↓+2H+;
(4)利用生產過程中的廢液與軟錳礦(主要成分為MnO2)反應生產硫酸錳(MnSO4,易溶于水),利用二氧化錳的氧化性氧化亞鐵離子為三價鐵離子,反應的離子方程式為MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案為:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(5)①用石墨作陽極、鈦網作陰極、熔融CaF2-CaO作電解質,陽極發生氧化反應,陰極析出鈣金屬發生還原反應,陽極圖示產物可可知,陽極生成二氧化碳氣體,是電解質中的氧離子失電子生成氧氣,氧氣和陽極石墨反應生成的二氧化碳,所以電極反應為:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
②陰極上電極反應式為:2Ca2++4e-═2Ca,陽極上電極反應為:2O2--4e-=O2↑,電解槽中發生反應:2CaO$\frac{\underline{\;電解\;}}{\;}$2Ca+O2↑,鈣還原二氧化鈦反應方程式為:2Ca+TiO2=Ti+2CaO,在制備金屬鈦前后,整套裝置中CaO的總量不變;
(6)如果取鈦鐵礦4t,生產出1.6噸的二氧化鈦,其中鈦元素的質量是1.6×$\frac{48}{80}$×100%=0.96t,所以鈦鐵礦中鈦的質量分數$\frac{0.96}{4}$×100%=24%,
故答案為:24%.
點評 本題考查了二氧化鈦的制備,考查了物質分離的流程分析判斷,物質性質的應用,離子性質的應用,分離操作的方法,氧化還原反應的離子方程式的書寫方法,電解池原理的應用,側重于學生的分析能力和實驗能力的考查,為高考常見題型,注意相關知識的學習與積累,題目難度中等.


 學而優銜接教材南京大學出版社系列答案
學而優銜接教材南京大學出版社系列答案 小學課堂作業系列答案
小學課堂作業系列答案 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:選擇題
| A. | 銅晶體的堆積方式為面心立方最密堆積 | |
| B. | H2O很穩定是因為水中有氫鍵 | |
| C. | 氯化鈉熔化破壞了離子鍵 | |
| D. | 12g金剛石中含有的碳碳鍵數目為2 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 11.2L | B. | 22.4L | C. | 33.6L | D. | 44.8L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 羧酸通常用芳香烴的氧化來制備.芳香烴的苯環比較穩定,難于氧化,而環上的支鏈不論長短,在強烈氧化時,最終都氧化成羧基.某同學用甲苯的氧化反應制備苯甲酸.反應原理:
羧酸通常用芳香烴的氧化來制備.芳香烴的苯環比較穩定,難于氧化,而環上的支鏈不論長短,在強烈氧化時,最終都氧化成羧基.某同學用甲苯的氧化反應制備苯甲酸.反應原理:

| 名稱 | 相對分 子質量 | 性狀 | 熔點 | 沸點 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 無色液體易燃易揮發 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片狀或針狀晶體 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
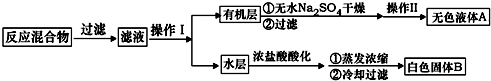
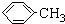 .操作Ⅱ為蒸餾.
.操作Ⅱ為蒸餾.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
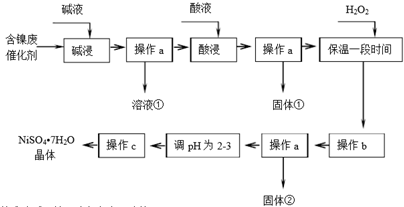
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 開始沉淀pH | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com