
| A. | 0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| C. | 0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2 | |
| D. | 0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2 |
分析 根據等效平衡解答,恒溫恒容下,該反應前后氣體體積不發生變化,將物質全部轉化到左邊滿足n(CO):n(H2O)=1:2,為等效平衡,平衡時CO的體積分數相同,不同配比達到平衡時CO的體積分數大于原平衡中CO的體積分數x,說明不同配比全部轉化到左邊應n(CO):n(H2O)>1:2,據此解答.
解答 解:恒溫恒容下,該反應前后氣體體積不發生變化,將物質全部轉化到左邊滿足n(CO):n(H2O)=1:2,為等效平衡,平衡時CO的體積分數相同,不同配比達到平衡時CO的體積分數大于原平衡中CO的體積分數x,說明不同配比全部轉化到左邊應n(CO):n(H2O)>1:2,
A.0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2等效為1.5 molCO+3 molH2O(g),n(CO):n(H2O)=1:2,平衡時CO的體積分數為x,故A不符合;
B.1mol CO+1mol H2O(g)+1mol CO2+1mol H2等效為2 molCO+2 molH2O(g),n(CO):n(H2O)=1:1>1:2,平衡時CO的體積分數大于x,故B符合;
C.0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2等效為0.9 molCO+1.9 molH2O(g),n(CO):n(H2O)=9:19<1:2,平衡時CO的體積分數小于x,故C不符合;
0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2等效為1 molCO+2 molH2O(g),n(CO):n(H2O)=1:2,平衡時CO的體積分數等于x,故D不符合,
故選:B.
點評 本題考查等效平衡等,理解等效平衡規律是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
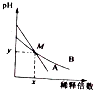 室溫下,pH相差1的兩種一元堿溶液A和B,分別加水稀釋時,溶液的pH變化如圖所示,下列說法正確的是( )
室溫下,pH相差1的兩種一元堿溶液A和B,分別加水稀釋時,溶液的pH變化如圖所示,下列說法正確的是( )| A. | 稀釋前,c(A)=10c(B) | |
| B. | 在M點,A、B兩種堿溶液中陽離子的物質的量濃度相等 | |
| C. | 稀釋前,A溶液中由水電離出的OH-的濃度大于10-7mol/L | |
| D. | 由圖可知,A為強堿,B為弱堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,11.2L CH4中含有的氫原子數為2NA | |
| B. | 11.2 L CO2與8.5 g NH3所含分子數相等 | |
| C. | 常溫下,2.7g鋁與足量的鹽酸反應,失去的電子數為0.3NA | |
| D. | 常溫下,1L 0.1mol/L MgCl2溶液中含Cl- 數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在恒容密閉容器中通入A,B兩種氣體,在一定條件下發生反應:2A(g)+B(g)?C(g)△H>0,達到平衡后,改變一個條件(x),下列量(y)一定符合圖中曲線的是( )
在恒容密閉容器中通入A,B兩種氣體,在一定條件下發生反應:2A(g)+B(g)?C(g)△H>0,達到平衡后,改變一個條件(x),下列量(y)一定符合圖中曲線的是( )| x | y | |
| A | 通入A氣體 | B的轉化率 |
| B | 加入催化劑 | A的體積分數 |
| C | 增大壓強 | 混合氣體的總物質的量 |
| D | 升高溫度 | 混合氣體的總物質的量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用高效低毒的農藥,既能提高作物產量,又能降低農藥殘留量 | |
| B. | 食品包裝袋中常放入生石灰作為抗氧化劑,防止食品變質 | |
| C. | 水瓶膽中的水垢可用飽和食鹽水清洗 | |
| D. | 明礬可用于凈水,也可用于淡化海水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 做金屬鈉與水反應實驗時,剩余的鈉不能再放入原試劑瓶 | |
| B. | 酸式滴定管裝標準液前,必須先用該溶液潤洗 | |
| C. | 錐形瓶用作反應容器時一定不能加熱 | |
| D. | 用容量瓶配溶液時,若加水超過刻度線,立即用滴定管吸出多余液體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHC03水溶液顯堿性,溶液中陽離子電荷總數小于陰離子電荷總數 | |
| B. | SiO2不跟堿反應,但可與氫氟酸反應 | |
| C. | NO2難液化,易溶于水并跟水反應 | |
| D. | Fe3O4能與濃鹽酸反應生成FeCl2和FeCl3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com