
| A. | AlCl3溶液中加入過量稀氨水:A13++4NH3•H2O═A1O2-+4NH4++2H2O | |
| B. | (NH4)2Fe(SO4)2溶液與過量NaOH溶液反應制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 溶液中加入過量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
分析 A.氨水為弱堿,反應生成的是氫氧化鋁沉淀;
B.氫氧化鈉過量,銨根離子和亞鐵離子都參與反應;
C.碳酸氫鈉少量,反應產物中不會存在碳酸根離子;
D.氫氧化鈉過量,反應生成氫氧化鎂沉淀、碳酸鈉和水.
解答 解:A.氯化鋁與氨水反應生成氫氧化鋁沉淀和氯化銨,正確的離子方程式為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A錯誤;
B.(NH4)2Fe(SO4)2溶液與過量NaOH溶液反應制Fe(OH)2,銨根離子也參與反應,正確的離子方程式為:2NH4+Fe2++4OH-═Fe(OH)2↓+2NH3•H2O,故B錯誤;
C.澄清石灰水中滴加少量NaHCO3,反應生成碳酸鈣沉淀、氫氧化鈉和水,正確的離子方程式為:Ca2++OH-+HCO3-═CaCO3↓+H2O,故C錯誤;
D.溶液中加入過量的NaOH溶液,反應的離子方程式為:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O,故D正確;
故選D.
點評 本題考查了離子方程式的書寫判斷,題目難度不大,注意明確離子方程式正誤判斷常用方法:檢查反應能否發生,檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合原化學方程式等.


科目:高中化學 來源: 題型:推斷題
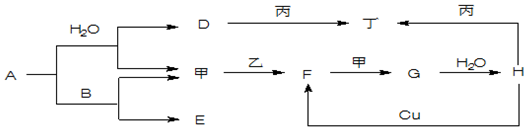
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬陽離子被還原時不一定得到金屬單質 | |
| B. | 非金屬元素的最高價含氧酸都具有強氧化性 | |
| C. | 由共價鍵形成的分子一定是共價化合物 | |
| D. | 直徑介于1nm~100nm之間的微粒成為膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸銅溶液可將方鉛礦(PbS)為銅藍(CuS) Cu2++SO42-+PbS═CuS+PbSO4 | |
| B. | 向次氯酸鈣溶液中通入少量二氧化硫氣體 Ca2++2 ClO-+SO2+H2O═CaSO4↓+2HClO | |
| C. | 向氫氧化鋇溶液加入過量的硫酸溶液的 Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向氯化鐵溶液加入過量的硫化鈉溶液 2Fe3++3S2-═2FeS↓+S↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎂離子的結構示意圖: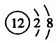 | B. | 苯甲酸乙酯的結構簡式: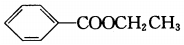 | ||
| C. | CO2的電子式: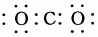 | D. | 中子數為18的氯原子:${\;}_{17}^{18}$Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaAH4中氫元素的化合價為+1價 | |
| B. | 若有1 mol NaAl4生成,則轉移4 mol電子 | |
| C. | 反應中氧化劑與還原劑的物質的量之比為3:2 | |
| D. | 氫化鋁鈉溶于水時除有氣泡產生外,還有大量的白色沉淀生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4.2×10-10 mol•L-1 | B. | 8.4×10-10 mol•L-1 | ||
| C. | 3.1×10-10 mol•L-1 | D. | 5.8×10-10 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向試管中滴加溶液時,滴管尖嘴不能伸入試管口內 | |
| B. | 不能將滴管水平拿持 | |
| C. | 加完藥品后應將滴管洗凈后再放回原瓶 | |
| D. | 滴管除了原滴瓶外,不能放在別的地方 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com