
分析 (1)分散質粒度介于1-100nm的分散系屬于膠體,膠體具有丁達爾效應、聚沉的性質,不能通過半透膜;
(2)根據反應中元素的化合價的變化結合原子守恒和電子守恒書寫方程式;
(3)依據硫酸在反應中硫元素化合價變化及生成產物判斷;
(4)根據電子轉移的數目與氧化劑或還原劑之間的物質的量的關系進行計算;
(5)運用極限法假設蒸干前溶質全為氫氧化鈉時物質的量為0.1mol,質量為4g;假如全都是碳酸鈉,則物質的量為0.5mol,質量為5.3g,假如全都是碳酸氫鈉時,物質的量為0.1mol,質量為8.4g,而實際質量為7.16g,所以為碳酸鈉與碳酸氫鈉的混合物,依據二氧化碳與氫氧化鈉反應得到產物關系結合原子個數守恒計算碳酸鈉與碳酸氫鈉的物質的量,據此解答.
解答 解:(1)碳納米顆粒大小介于1-100nm,所以分散到一定溶劑中,形成穩定的分散系屬于膠體,膠體具有丁達爾效應、聚沉的性質,不能通過半透膜;
故答案為:①②;
(2)反應中C被氧化生成CO2、K2Cr2O7被還原為Cr2(SO4)3依據反應過程中得失電子守恒和原子個數守恒可配平方程式得:
3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O,
故答案為:3;2K2Cr2O7;8;2;3CO2;2;8;
(3)H2SO4在上述反應中所含元素化合價不變,與金屬陽離子結合生成鹽,表現出酸性,
故選:C;
(4)依據方程式可知每生成3mol二氧化碳氣體,反應轉移電子的物質的量為12mol,所以若反應中電子轉移了0.8mol,則生成二氧化碳氣體的物質的量為0.2mol,標況下體積為:0.2mol×22.4L/mol=4.48L,故答案為:4.48L.
(5)假設蒸干前溶質全為氫氧化鈉時物質的量為0.1mol,質量為4g;假如全都是碳酸鈉,則物質的量為0.5mol,質量為5.3g,假如全都是碳酸氫鈉時,物質的量為0.1mol,質量為8.4g,而實際質量為7.16g,所以為碳酸鈉與碳酸氫鈉的混合物,設碳酸氫鈉的物質的量為x,碳酸鈉的量為y,蒸干碳酸氫鈉與碳酸鈉的混合物最終得到產物為碳酸鈉,則依據鈉原子個數守恒可得:
x+2y=0.1;依據質量守恒可得:x+y=$\frac{7.16g}{106g/mol}$;
解得:x=0.036mol,y=0.032mol,
碳酸鈉為強電解質,完全電離產生碳酸根離子和鈉離子;部分碳酸根離子水解生成碳酸氫根離子和氫氧根離子;
碳酸氫鈉為強電解質,完全電離產生碳酸氫根離子和鈉離子,碳酸氫根離子部分水解生成碳酸和氫氧根離子,
所以溶液中離子濃度大小順序為:C(Na+)>C(HCO-3)>C(CO2-3)>C(OH-)>C(H+);
故答案為:C(Na+)>C(HCO-3)>C(CO2-3)>C(OH-)>C(H+).
點評 本題考查了膠體的性質、氧化還原方程式的書寫、離子濃度大小的比較,熟悉氧化還原反應得失電子守恒規律是解題關鍵,題目難度中等.


 課課練江蘇系列答案
課課練江蘇系列答案 名牌中學課時作業系列答案
名牌中學課時作業系列答案 明天教育課時特訓系列答案
明天教育課時特訓系列答案 浙江新課程三維目標測評課時特訓系列答案
浙江新課程三維目標測評課時特訓系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol冰醋酸、0.1mol無水乙醇和濃硫酸混合加熱后可得0.1NA個乙酸乙酯分子 | |
| B. | 0.1molL-1Na2SO4溶液中含2NA個Na+ | |
| C. | 2.7g的鋁是足量的NaOH溶液充分反應,轉移的電子數為0.3NA | |
| D. | 標準狀況下,11.2升CCl4中所含的氯原子數目為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.008889 | B. | 0.08000 | C. | 0.1200 | D. | 0.2400 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
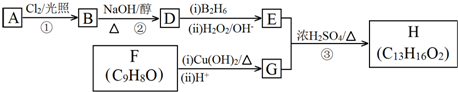
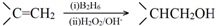
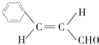 .
.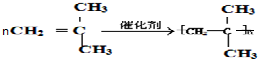 .
.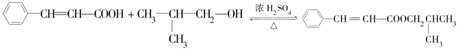 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Cu是還原劑,被腐蝕 | B. | Fe2+是氧化產物 | ||
| C. | 該反應是置換反應 | D. | 該反應屬于離子反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 葡萄糖、麥芽糖均能與新制Cu(OH)2反應 | |
| B. | 富含蛋白質的豆漿煮沸后即可得人體所需的氨基酸 | |
| C. | 當人誤食重金屬鹽時,可喝大量的牛奶、蛋清解毒 | |
| D. | 油脂在氫氧化鉀溶液中水解可制得汽車洗滌用的液體肥皂 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
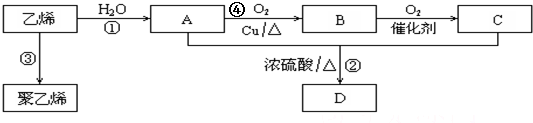
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 煤的氣化、液化是使煤變成清潔能源,減少環境污染的有效途徑 | |
| B. | 高純硅可制作太陽能電池,二氧化硅可制作光導纖維 | |
| C. | 利用工業生產產生的二氧化碳制造全降解塑料,可以緩解溫室效應 | |
| D. | 棉、麻、羊毛及合成纖維完全燃燒都只生成CO2和H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗 | 現象 | 離子方程式 |
| A | 向氯化鋁溶液中滴加過量氨水 | 有白色沉淀產生 | Al3++3OH-=Al(OH)3↓ |
| B | 向FeBr2溶液中通入少量氯氣 | 溶液由淺綠色變成黃色 | 2Fe2++Cl2=2Fe3++2Cl- |
| C | 向稀硝酸中加入單質Fe粉 | 有氣泡生成 | Fe+6H+=3Fe3++3H2↑ |
| D | 向Na2CO3溶液中滴加酚酞試劑 | 溶液由無色變為紅色 | CO32-+H2O=H2CO3+2OH- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com