
 (1)在25℃、101kPa下,1g甲烷完全燃燒生成CO2和液態H2O,放出55kJ的熱量,寫出表示甲烷燃燒熱的熱化學方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.
(1)在25℃、101kPa下,1g甲烷完全燃燒生成CO2和液態H2O,放出55kJ的熱量,寫出表示甲烷燃燒熱的熱化學方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.分析 (1)燃燒熱是1mol可燃物完全燃燒生成穩定氧化物放出的熱量,依據概念書寫熱化學方程式,標注物質聚集狀態和對應焓變;
(2)根據蓋斯定律,利用已知的熱化學方程式乘以適當的系數進行加減構造目標熱化學方程式,反應熱也乘以相應的系數進行相應的加減;
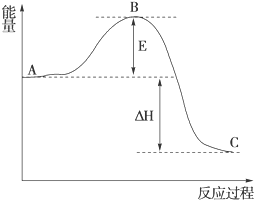
(3)①根據圖象來分析;
②反應的反應熱取決與反應物和生成物總能量的差值;催化劑能參與反應,降低反應的活化能;
③根據參加反應SO2的物質的量之比等于對應的△H之比來計算.
解答 解:(1)燃燒熱是1mol可燃物完全燃燒生成穩定氧化物放出的熱量,依據概念書寫熱化學方程式,標注物質聚集狀態和對應焓變,在25℃、101kPa下,1g甲烷完全燃燒生成CO2和液態H2O,放出55kJ的熱量,1mol甲烷燃燒生成穩定氧化物放熱880KJ,表示甲烷燃燒熱的熱化學方程式為:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880 kJ/mol;
故答案為:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880 kJ/mol;
(2)已知①2Zn(s)+O2(g)=2ZnO(s)△H1=-702kJ/mol
②2Hg(l)+O2(g)=2HgO(s)△H2=-182kJ/mol
根據蓋斯定律,$\frac{1}{2}$(①-②)得Zn(s)+HgO(s)=ZnO(s)+Hg(l),
則△H3=$\frac{1}{2}$(△H1-△H2)=$\frac{1}{2}$(-702kJ/mol+182kJ/mol)=-260kJ/mol,
故答案為:-260kJ/mol.
(3)①根據圖象可知,E為正反應的活化能,C為生成物的總能量,故答案為:正反應活化能,生成物總能量;
②反應的反應熱取決與反應物和生成物總能量的差值,與正逆反應的活化能無關,即E的大小不影響反應熱;催化劑能參與反應,改變反應的路徑,降低反應的活化能,故能使B點降低,故答案為:無,降低,因為催化劑改變了反應的歷程使活化能E降低;
③因1mol SO2(g)氧化為1mol SO3的△H=-99kJ•mol-1,所以2mol SO2(g)氧化為2mol SO3的△H=-198kJ•mol-1,
則2SO2(g)+O2(g)=2SO3(g)△H=-198kJ•mol-1,故答案為:-198kJ•mol-1.
點評 本題主要考查了反應過程的能量變化圖以及運用蓋斯定律進行反應熱的計算,難度不大.


 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鈉熔成光亮的小球,在液面四處游動 | |
| B. | 有氣體產生 | |
| C. | 溶液底部有銀白色的物質 | |
| D. | 溶液變渾濁 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 砝碼質量/g | 50 | 20 | 20 | 10 | 5 |
| 稱量(取用砝碼過程) |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗現象 | 結論 |
| A | 把相同大小的一塊鋁和鎂分別投入相同濃度的鹽酸中,鎂溶解有氣泡產生,而鋁沒有任何變化 | 鎂的金屬性比鋁強 |
| B | 取一塊鋁箔,用酒精燈點燃,鋁箔只熔化成液體 | 鋁不易燃燒 |
| C | 向氯化銨溶液中投入一鋁片,鋁上產生大量氣泡 | 該氣體是氫氣 |
| D | 向氯化鋁溶液中逐滴滴加NaOH溶液至過量,先產生沉淀,后沉淀逐漸溶解,最后沉淀完全消失 | 氫氧化鋁能溶解于強堿溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com