

分析 實驗室利用硫酸亞鐵制取聚鐵,在硫酸亞鐵溶液中加入濃硫酸調節PH值,用雙氧水將亞鐵離子氧化成鐵離子,利用鐵離子水解,再與硫酸根結合生成聚鐵,進而得到固態聚鐵,
(1)雙氧水具有強氧化性,能夠將亞鐵離子氧化成鐵離子,據此寫出反應的離子方程式;
(2)根據亞鐵離子在溶液中易水解,所以加酸可以抑制亞鐵離子的水解,同時酸性條件下雙氧水的氧化性增強;
(3)由FeSO4生成聚合硫酸鐵[Fe2(OH)n(SO4)(3-0.5n)]m,反應物為:FeSO4、H2O2、H2SO4,生成物為:[Fe2(OH)n(SO4)(3-0.5n)]m,亞鐵離子化合價從+2升高1價變為+3價鐵離子,由于產物[Fe2(OH)n(SO4)(3-0.5n)]m中含有m個鐵離子,則化合價至少升高m價,雙氧水中O元素從-1價較低為-2價,化合價降低1價,雙氧水中含有2個O原子,至少降低2價,所以化合價變化的最小公倍數為2m,硫酸亞鐵的系數為2,雙氧水的系數為m,然后根據質量守恒定律配平反應的方程式;
(4)①根據題意,過量的SnCl2和Fe3+反應生成 Fe2+和SnCl62-,根據電子得失守恒和元素守恒可書寫反應的離子方程式;
②根據Sn2+能夠還原Cr2O72-而造成較大的實驗誤差進行判斷;
③根據關系式6Fe2+~Cr2O72-計算出亞鐵離子物質的量,進而計算聚鐵中鐵的質量分數.
解答 解:(1)硫酸亞鐵溶液中加入雙氧水后,亞鐵離子被雙氧水氧化成鐵離子,反應的離子方程式為:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案為:2Fe2++2H++H2O2=2Fe3++2H2O;
(2)根據制取流程可知,下一步需要加入雙氧水氧化亞鐵離子,雙氧水在酸性條件下氧化性增強,所以加入濃硫酸后可以提高雙氧水的氧化能力;亞鐵離子在溶液中容易發生水解,加入濃硫酸增大溶液中氫離子,可以抑制Fe2+水解,
故答案為:抑制Fe2+水解;提高H2O2的氧化能力(或促進Fe2+被氧化);
(3)由FeSO4生成聚合硫酸鐵[Fe2(OH)n(SO4)(3-0.5n)]m,反應物為:FeSO4、H2O2、H2SO4,生成物為:[Fe2(OH)n(SO4)(3-0.5n)]m,亞鐵離子化合價從+2升高1價變為+3價鐵離子,由于產物[Fe2(OH)n(SO4)(3-0.5n)]m中含有m個鐵離子,則化合價至少升高m價,雙氧水中O元素從-1價較低為-2價,化合價降低1價,雙氧水中含有2個O原子,至少降低2價,所以化合價變化的最小公倍數為2m,硫酸亞鐵的系數為2,雙氧水的系數為m,然后根據質量守恒定律配平,配平后的方程式為:2mFeSO4+mH2O2+(1-0.5n)mH2SO4=[Fe2(OH)n(SO4)(3-0.5n)]m+(2-n)mH2O,
故答案為:2mFeSO4+mH2O2+(1-0.5n)mH2SO4=[Fe2(OH)n(SO4)(3-0.5n)]m+(2-n)mH2O;
(4)①過量的SnCl2和Fe3+反應生成Fe2+和SnCl62-,鐵離子化合價從+3變為+2,化合價降低1價;SnCl2中Sn元素化合價從+2變為SnCl62-中的+4,化合價升高2價,則化合價變化的最小公倍數為2,所以鐵離子的系數為2,Sn2+的系數為1,配平后的反應方程式為:Sn2++2Fe3++6Cl-=2Fe2++SnCl62-,
故答案為:Sn2++2Fe3++6Cl-=2Fe2++SnCl62-;
②Sn2+能夠被Cr2O72-氧化,所以為防止滴定過程中由于Sn2+同時還原Cr2O72-而造成較大的實驗誤差,需要用HgCl2除去過量的SnCl2,
故答案為:防止滴定過程中由于Sn2+同時還原Cr2O72-而造成較大的實驗誤差;
③氧化還原反應中化合價升降相等,亞鐵被氧化成鐵離子,轉移1個電子,Cr2O72-被還原為Cr3+,轉移6個電子,根據電子守恒可得:
6Fe2+~Cr2O72-,
6mol 1mol
n 0.1000mol/L×0.0128L
則:n=$\frac{6mol×0.1000mol/L×0.0128L}{1mol}$=0.00768mol,
故聚鐵中鐵的質量分數為:$\frac{0.00768mol×\frac{100mL}{20mL}×56g/mol}{10.00g}$×100%=21.5%,
故答案為:21.5.
點評 本題考查了物質制備實驗方案的設計,題目難度中等,涉及了元素質量分數的計算、氧化還原反應的配平等知識,試題綜合性較強,充分考查了的學生的分析、理解能力及化學計算能力,是一道質量較高的題目.


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 聯堿法對母液的處理方法是向母液中通入二氧化碳,冰凍和加食鹽 | |
| B. | 列管式熱交換器的使用實現了原料的充分利用 | |
| C. | 焙燒辰砂制取汞的反應原理為:HgS+O2$\stackrel{焙燒}{→}$Hg+SO2 | |
| D. | 氯堿工業、鋁的冶煉、犧牲陽極的陰極保護法都是應用了電解池的原理 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
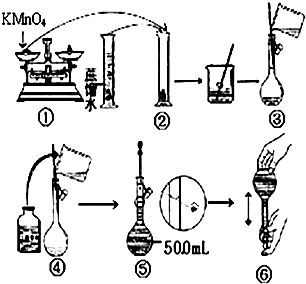 人體血液里Ca2+離子的濃度一般采用g/cm3來表示.抽取一定體積的血樣,加適量的草酸銨[(NH4)2C2O4]溶液,可析出草酸鈣(CaC2O4)沉淀,將此草酸鈣沉淀洗滌后溶于強酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可測定血液樣品中Ca2+的濃度.某研究性學習小組設計如下實驗步驟測定血液樣品中Ca2+的濃度:
人體血液里Ca2+離子的濃度一般采用g/cm3來表示.抽取一定體積的血樣,加適量的草酸銨[(NH4)2C2O4]溶液,可析出草酸鈣(CaC2O4)沉淀,將此草酸鈣沉淀洗滌后溶于強酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可測定血液樣品中Ca2+的濃度.某研究性學習小組設計如下實驗步驟測定血液樣品中Ca2+的濃度:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
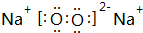 (用電子式表示)
(用電子式表示)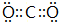 (用電子式表示)
(用電子式表示)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
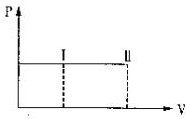 一帶有活塞的密封容器中盛有A、B組成的混合氣體,在通常條件下,從狀態I反應到狀態II時,氣體體積(V)與氣體壓強(P)的變化曲線如圖所示.
一帶有活塞的密封容器中盛有A、B組成的混合氣體,在通常條件下,從狀態I反應到狀態II時,氣體體積(V)與氣體壓強(P)的變化曲線如圖所示.| A. | 是放熱反應 | |
| B. | 反應后氣體總分子數增多 | |
| C. | 是吸熱反應 | |
| D. | 反應物具有的總能量等于生成物具有的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入NaOH,溶液pH升高,c(SO32-)增大 | B. | 氯化鋇有兩性 | ||
| C. | 兩支試管中的白色沉淀都是BaSO4 | D. | SO2具有兩性且水溶液有酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 水是生命之源,它與我們的生活密切相關.在化學實驗和科學研究中,水也是一種常用的試劑.
水是生命之源,它與我們的生活密切相關.在化學實驗和科學研究中,水也是一種常用的試劑.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com