
| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| 1 |
| 2 |
| T/℃ | t/min | |||
| pH=10.0 | pH=9.0 | pH=8.0 | pH=7.0 | |
| 15 | 30 | 24 | 16 | 6 |
| 20 | 18 | 13 | 8 | 4 |
| 25 | 12 | 8 | 3 | 2 |
| △c |
| △t |
| m |
| V |
| 2 |
| 3 |
| △c |
| △t |
| 0.04mol/L |
| 8min |


 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:
| A、NaClO溶液與FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
| B、NH4HSO3溶液與足量NaOH溶液共熱:NH4++H++2OH-═NH3↑+2H2O |
| C、向1L 1mol/L碘化亞鐵溶液中通入標準狀況下22.4L氯氣:2Fe2+-+Cl2═2Fe3+2Cl- |
| D、澄清石灰水與少量的小蘇打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:
 (1)1.7g NH3共有
(1)1.7g NH3共有查看答案和解析>>
科目:高中化學 來源: 題型:
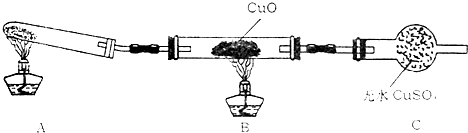
| H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 容器 編號 | 溫度(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A、該反應的正方應為吸熱反應 |
| B、達到平衡時,容器I中的CH3OH體積分數比容器Ⅱ中的小 |
| C、容器I中反應達到平衡所需時間比容器Ⅲ中的長 |
| D、若起始時向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,則反應將向正反應方向進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 元素編號 | 特征信息 |
| A | 其中一種原子核內只有質子沒有中子 |
| B | 其原子的L層電子數是K層的3倍 |
| C | 其陽離子與B的陰離子具有相同的電子層結構, 且核電荷數與B相差3 |
| D | 其原子的最外層電子數等于電子層數,且是地殼 中含量較多的元素之一 |
| E | 單質為黃綠色氣體,可用于制造漂白粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 催化劑 |
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
 請回答下列問題(均不考慮溫度變化對催化劑催化效率的影響):
請回答下列問題(均不考慮溫度變化對催化劑催化效率的影響):| 實驗編號 | T/℃ | NO初始濃度/mol?L-1 | CO初始濃度/mol?L-1 | 催化劑的比表面積/m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化學 來源: 題型:
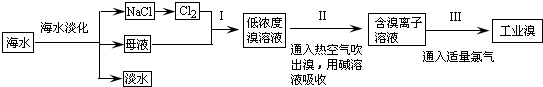
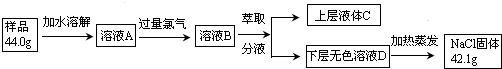
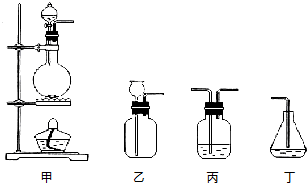
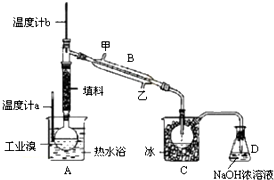
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com