
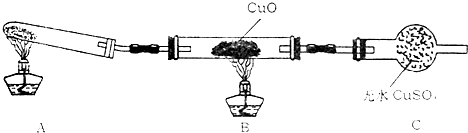
| H+ |
| ||
| ||
| ||
| ||
| ||


科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| A、金屬原子失電子越多,其還原性越強 |
| B、CH4的摩爾質量為16g |
| C、10g質量分數為98%的H2SO4,用水稀釋至100g,H2SO4的質量分數為9.8% |
| D、電解質物質本身一定導電 |
查看答案和解析>>
科目:高中化學 來源: 題型:

| 儀器編號 | 盛放的試劑 | 加入該試劑的目的 |
| B | 飽和NaHCO3溶液 | |
| C | 與CO2反應,產生O2 | |
| D | 吸收未反應的CO2氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 實驗變量 實驗序號 | 銀氨溶液的量/mL | 乙醛的量/滴 | 溫度/℃ | 反應混合液的pH | 出現銀鏡的時間/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |

查看答案和解析>>
科目:高中化學 來源: 題型:
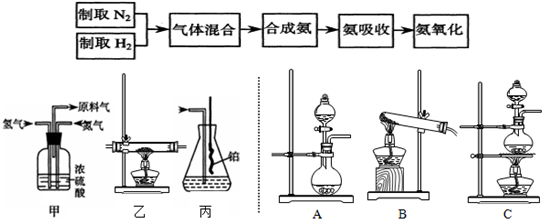
查看答案和解析>>
科目:高中化學 來源: 題型:
| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| 1 |
| 2 |
| T/℃ | t/min | |||
| pH=10.0 | pH=9.0 | pH=8.0 | pH=7.0 | |
| 15 | 30 | 24 | 16 | 6 |
| 20 | 18 | 13 | 8 | 4 |
| 25 | 12 | 8 | 3 | 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
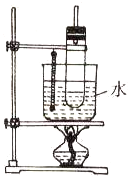 實驗室制取硝基苯常用如圖裝置:
實驗室制取硝基苯常用如圖裝置:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com