
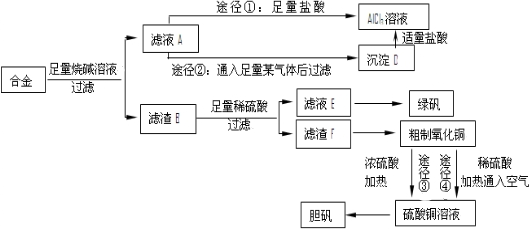
分析 含有鋁、鐵、銅的合金加入足量的氫氧化鈉溶解,只有鋁與氫氧化鈉溶液反應,所以濾渣B為鐵和銅,濾液中含有偏鋁酸鈉與剩余的NaOH,途徑①加入足量的鹽酸得到氯化鋁溶液,途徑②通入二氧化碳得到氫氧化鋁沉淀,氫氧化鋁用鹽酸溶解得到氯化鋁.濾渣B中用稀硫酸溶解,Cu不反應,過濾分離,濾渣F為Cu、濾液E中含有硫酸亞鐵,經過加熱濃縮、冷卻結晶、過濾、洗滌等操作得到綠礬.粗制氧化銅反應得到硫酸銅,再經過加熱濃縮、冷卻結晶、過濾、洗滌等操作得到藍礬.
(1)Al與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣;合金與燒堿溶液形成了原電池,Fe、Cu不與氫氧化鈉溶液溶液,則Al作負極;
(2)途徑①所得的溶液中含有NaCl;應防止氯化鋁溶液在加熱蒸發過程中水解;
(3)根據消耗硫酸用量及是否生成污染空氣的氣體分析;
(4)酸性條件下,氧氣與粗制氧化銅中的Cu反應得到Cu2+,過濾除去不溶物后,經過加熱濃縮、冷卻結晶、過濾、洗滌等操作得到藍礬;
(5)先稱量樣品與坩堝質量,再加熱分解,稱量加熱后總質量,兩次處理誤差在系統誤差范圍內,說明完全失去結晶水;
a.加熱溫度過高,硫酸銅可能分解;
b.膽礬晶體的顆粒較大,結晶水不能完全失去;
c.加熱后放在空氣中冷卻,有吸收空氣中水蒸氣;
d.膽礬晶體部分風化,晶體中結晶水的質量偏小;
e.加熱時膽礬晶體飛濺出來,失去的晶體全部按結晶水質量計算;
f.所用坩堝事先未干燥(潮濕),沉淀結晶水的質量偏大.
解答 解:含有鋁、鐵、銅的合金加入足量的氫氧化鈉溶解,只有鋁與氫氧化鈉溶液反應,所以濾渣B為鐵和銅,濾液中含有偏鋁酸鈉與剩余的NaOH,途徑①加入足量的鹽酸得到氯化鋁溶液,途徑②通入二氧化碳得到氫氧化鋁沉淀,氫氧化鋁用鹽酸溶解得到氯化鋁.濾渣B中用稀硫酸溶解,Cu不反應,過濾分離,濾渣F為Cu、濾液E中含有硫酸亞鐵,經過加熱濃縮、冷卻結晶、過濾、洗滌等操作得到綠礬.粗制氧化銅反應得到硫酸銅,再經過加熱濃縮、冷卻結晶、過濾、洗滌等操作得到藍礬.
(1)Al與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣,反應離子方程式為:2Al+2OH-+2H2O=2AlO2-+3H2↑,合金與燒堿溶液形成了原電池,Fe、Cu不與氫氧化鈉溶液溶液,則Al作負極,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al;
(2)途徑①所得的溶液中含有NaCl,途徑②是利用氫氧化鋁與鹽酸反應得到氯化鋁,制得氯化鋁比較純,途徑②更合理,氯化鋁溶液在加熱蒸發過程中應防止水解,具體操作為:將溶液低溫蒸發濃縮過濾,所得固體在氯化氫的氛圍里蒸干,
故答案為:途徑②;將溶液低溫蒸發濃縮過濾,所得固體在氯化氫的氛圍里蒸干;
(3)途徑③中Cu會與濃硫酸反應生成硫酸銅與二氧化硫,途徑④中Cu與硫酸、氧氣反應生成硫酸銅,與途徑③相比,途徑④明顯具有的兩個優點是:產生等量膽礬途徑④消耗硫酸少、途徑④不會產生污染大氣的氣體,
故答案為:產生等量膽礬途徑④消耗硫酸少、途徑④不會產生污染大氣的氣體;
(4)酸性條件下,氧氣與粗制氧化銅中的Cu反應得到Cu2+,反應離子方程式為:2Cu+O2+4H+=2Cu2++2H2O,過濾除去不溶物后,經過加熱濃縮、冷卻結晶、過濾、洗滌等操作得到藍礬,
故答案為:加熱濃縮、過濾;2Cu+O2+4H+=2Cu2++2H2O;
(5)先稱量樣品與坩堝質量,再加熱分解,稱量加熱后總質量,兩次處理誤差在系統誤差范圍內,說明完全失去結晶水,至少進行4次質量稱量;
a.加熱溫度過高,硫酸銅可能分解,測定結晶水質量偏大,導致x值偏高;
b.膽礬晶體的顆粒較大,結晶水不能完全失去,測定結晶水質量偏小,導致x值偏低;
c.加熱后放在空氣中冷卻,有吸收空氣中水蒸氣,測定結晶水質量偏小,導致x值偏低;
d.膽礬晶體部分風化,晶體中結晶水的質量偏小,導致x值偏低;
e.加熱時膽礬晶體飛濺出來,失去的晶體全部按結晶水質量計算,測定結晶水質量偏大,導致x值偏高;
f.所用坩堝事先未干燥(潮濕),沉淀結晶水的質量偏大,導致x值偏高,
故答案為:4;aef.
點評 本題考查物質制備工藝流程,涉及多操作的分析評價、物質的分離提純、物質含量測定等,側重于學生的分析能力、實驗能力的考查,為高考常見題型,注意把握實驗的操作原理和步驟,難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ①③②④ | C. | ②①④③ | D. | ①④②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等物質的量濃度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小關系為:②>④>③>① | |
| B. | pH=2的H2C2O4溶液與pH=12的NaOH溶液等體積混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等體積0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常溫下,同濃度的CH3COONa與CH3COOH溶液等體積混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 都比較穩定,久置不變渾濁 | B. | 相同的顏色 | ||
| C. | 有丁達爾現象 | D. | 加鹽酸先產生沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
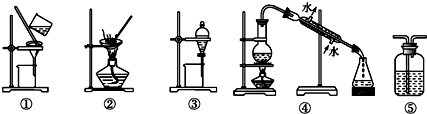
| A. | 用FeCl2溶液吸收Cl2,選⑤ | B. | 分離Na2CO3溶液和油脂,選④ | ||
| C. | 用四氯化碳提取碘水中的碘,選③ | D. | 粗鹽提純,選①和② |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | A | B→C化學方程式 |
| ① | ||
| ② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ④⑤⑥ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com