
【題目】實驗室以綠礬(FeSO4·7H2O)為鐵源制備補血劑甘氨酸亞鐵[(NH2CH2COO)2Fe],有關物質性質如下:
甘氨酸((NH2CH2COOH) | 檸檬酸 | 甘氨酸亞鐵 |
易溶于水,微溶于乙醇,兩性化合物 | 易溶于水和乙醇,有強酸性和還原性 | 易溶于水,難溶于乙醇 |
實驗過程:
Ⅰ.配制含0.10molFeSO4的水溶液。
Ⅱ.制備FeCO3:向配制好的FeSO4溶液中,緩慢加入200mL 1.1mol·L-1NH4HCO3溶液,邊加邊攪拌,反應結束后過濾并洗滌沉淀。
Ⅲ.制備(NH2CH2COO)2Fe:實驗裝置如圖(夾持和加熱儀器已省略),將實驗Ⅱ得到的沉淀(過量)和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反應將C中空氣排盡,接著滴入檸檬酸溶液并加熱。反應結束后過濾,濾液經蒸發結晶、過濾、洗滌、干燥后得到產品。

回答下列問題:
(1)儀器P的名稱是_______。
(2)實驗Ⅰ配制FeSO4溶液時,為防止FeSO4被氧化變質,應加入的試劑為_______(填化學式)。
(3)實驗Ⅱ中,生成沉淀的離子方程式為_____。
(4)實驗Ⅲ中,
①檢查裝置A的氣密性的方法是______。
②檸檬酸可調節pH,體系pH與產率的關系如下表:
實驗 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
體系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
產率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
pH過低會使產率下降,其原因是______;檸檬酸的作用還有_____(填字母)。
A.作催化劑
B.作反應終點指示劑
C.促進FeCO3溶解
D.防止二價鐵被氧化
③洗滌實驗Ⅲ中得到的沉淀,所選用的最佳洗滌試劑是_____(填字母)。
A.熱水 B.稀硫酸
C.乙醇 D.檸檬酸溶液
(5)若產品的質量為16.32g,則產率為_____。
【答案】恒壓漏斗(答分液漏斗也給分) Fe Fe2++2HCO3-═FeCO3↓+CO2↑+H2O 關閉彈簧夾,從長頸漏斗注入一定量的水,使漏斗內的水面高于具支試管中的水面,停止加水一段時間后,若長頸漏斗與具支試管中的液面差保持不變,說明裝置不漏氣(答案合理即可) H+會與NH2CH2COOH反應 CD C 80%
【解析】
弄清楚實驗目的,實驗目的是制備甘氨酸亞鐵,理解實驗原理,實驗原理是FeCO3在檸檬酸的作用下與甘氨酸反應,Fe2++2NH2CH2COOH=(NH2CH2COO)2Fe,然后針對問題展開而分析。
(1)根據儀器P的特點,儀器P為恒壓漏斗或恒壓滴液漏斗;
(2)Fe2+容易被氧氣氧化,同時Fe+2Fe3+=3Fe2+,不引入雜質,因此保存FeSO4時,應加入的試劑為Fe;
(3)FeSO4溶液中加入NH4HCO3溶液發生反應,產物是FeCO3和CO2,其離子方程式為Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(4)①檢驗裝置A的氣密性,其方法是關閉彈簧夾,從長頸漏斗注入一定量的水,使漏斗內的水面高于具支試管中的水面,停止加水一段時間后,若長頸漏斗與具支試管中的液面差保持不變,說明裝置不漏氣;
②-NH2顯堿性,pH過低時,H+能與-NH2發生反應,產率降低;檸檬酸有強酸性,能使FeCO3溶解,作用之一是調節pH促進FeCO3溶解,根據信息,檸檬酸具有還原性,可防止Fe2+被氧化,因此選項CD符合題意;
③甘氨酸亞鐵易溶于水,難溶于乙醇,因此選擇乙醇溶液作為洗滌劑,故選項C正確;
(5)根據步驟Ⅲ,FeCO3過量,根據甘氨酸計算(NH2CH2COO)2Fe的質量,關系式為2NH2CH2COOH~(NH2CH2COO)2Fe,即甘氨酸亞鐵的理論質量為0.2mol×204g·mol-1/2=20.4g,產率=實際產量/理論產量×100%=16.32/20.4×100%=80%。


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:
【題目】關于下圖所示原電池裝置的敘述,正確的是
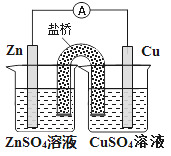
A. 銅是正極,銅片上有氣泡產生
B. 鋅片質量逐漸減少
C. 電子從銅片經導線流向鋅片
D. 鹽橋中陽離子向ZnSO4溶液移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中科院一項最新成果實現了甲烷高效生產乙烯,甲烷在催化作用下脫氫,在氣相 中經自由基偶聯反應生成乙烯,其反應如下:2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化學鍵 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相關化學鍵的鍵能如上表,甲烷制備乙烯反應的ΔH=_____________ (用含a.b.c.d的代數式表示)。

(1)T1溫度時,向1 L的恒容反應器中充入2 molCH4 ,僅發生上述反應,反應過程中 0~15 min CH4的物質的量隨時間變化如圖,測得10-15 min時H2的濃度為1.6 mol/L。
①0~ 10 min內CH4表示的反應速率為____mol/(Lmin) o
②若圖中曲線a、曲線b分別表示在溫度T1時,使用質量相同但表面積不同的催化劑 時,達到平衡過程中n (CH4)變化曲線,其中表示催化劑表面積較大的曲線是 ________ (填"a"或 “b”)。
③15 min時,若改變外界反應條件,導致n( CH4)發生圖中所示變化,則改變的條件可能是_____(任答一條即可)。
(3)實驗測得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆為速率常數僅與溫度有關,T1溫度時k正與K逆的比值為______ (填數值)。若將溫度由T1升高到T2,則反應速率增大的倍數V正 ____V逆(選填“〉”、“=”或“<”),判斷的理由是__________
(4)科研人員設計了甲烷燃料電池并用于電解。如圖所示,電解質是摻雜了 Y2O3與 ZrO2的固體,可在高溫下傳導O2-
①C極的Pt為_______ 極(選填“陽”或“陰” )。
②該電池工作時負極反應方程式為_____________________ 。
③用該電池電解飽和食鹽水,一段時間后收集到標況下氣體總體積為112 mL,則陰極區所得溶液在25 0C時pH=_______ (假設電解前后NaCl溶液的體積均為500 mL)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知![]() (X)、
(X)、![]() (Y)互為同分異構體,下列說法不正確的是
(Y)互為同分異構體,下列說法不正確的是
A. Y的一氯代物只有三種
B. X的所有原子可能處于同一平面
C. X、Y與足量氫氣完全加成時所需氫氣的物質的量之比為1:1
D. X、Y均可使溴的水溶液褪色,且褪色的原理相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵及其化合物在生產生活及科學研究方面應用非常廣泛。回答下列問題:
(1)Fe原子的核外電子排布式為_____。
(2)含錳奧氏體鋼是一種特殊的鐵合金,主要由Fe和Mn組成,其中錳能增加鋼鐵的強度和硬度,提高耐沖擊性能和耐磨性能。第一電離能I1(Fe)____(填“大于”或“小于”)I1(Mn),原因是___。
(3)FeF3具有較高的熔點(熔點高于1000℃),其化學鍵類型是__,FeBr3的式量大于FeF3,但其熔點只有200℃,原因是____。
(4)FeCl3可與KSCN、苯酚溶液發生顯色反應。
①SCN-的三種元素中電負性最大的是____。
②苯酚(![]() )分子中氧原子的雜化形式為___。苯酚分子中的大π鍵可用符號πmn表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數,則m=____,n=___。
)分子中氧原子的雜化形式為___。苯酚分子中的大π鍵可用符號πmn表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數,則m=____,n=___。
(5)Fe(CO)3與NH3在一定條件下可合成一種具有磁性的氮化鐵。該磁性氮化鐵的晶胞結構如圖所示。六棱柱底邊邊長為acm,高為ccm,阿伏加德羅常數的值為NA,該磁性氮化鐵的密度為____(列出計算式)g·cm-3。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、F五種物質的焰色反應均為黃色,A、B、C、D與鹽酸反應均生成E,此外B還生成一種可燃氣體。而C、D還生成一種無色無味氣體H,該氣體能使澄清石灰水變渾濁。D和A可反應生成C,F和H也可反應生成C和另一種無色無味氣體。
請回答下列問題:
(1)寫出A、B、C、D、E、F的化學式
A________;B________;C________;D________;E________;F________。
(2)寫出F和H反應的化學方程式 __________________________________。
(3)寫出下列反應的離子方程式:
①D+鹽酸 ________________________________________________;
②B+水 _____________________________________________________;
③D+A ______________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.1000mol/L的NaOH溶液滴定某濃度的二元弱酸(![]() )溶液,所得溶液中各種含X的微粒的物質的量分數(
)溶液,所得溶液中各種含X的微粒的物質的量分數(![]() )與pH的變化曲線如圖所示。下列說法正確的是
)與pH的變化曲線如圖所示。下列說法正確的是

A. ![]() 的電離常數
的電離常數![]() ,
, ![]() 的水解常數
的水解常數![]()
B. 由水電離出的c(![]() ):a>b
):a>b
C. 曲線![]() 分別表示
分別表示![]() (
(![]() )和
)和![]() (HX-)的變化
(HX-)的變化
D. b點所示溶液中:c(![]() >3c(
>3c(![]() )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電影《流浪地球》講述了太陽即將爆發氦閃”(3He![]() C),人類飛離太陽系的艱辛歷程.太陽質量中氫占71%,氦26%,氧、碳、鐵等元素占2%左右.下列說法正確的是
C),人類飛離太陽系的艱辛歷程.太陽質量中氫占71%,氦26%,氧、碳、鐵等元素占2%左右.下列說法正確的是
A. 核素![]() 的中子數比電子數多2
的中子數比電子數多2
B. 上述元素除氮之外僅能形成6種單質和4種氧化物
C. 碳、氫、氧元素組成的糖類物質均可發生水解
D. 上述元素組成的草酸亞鐵(FeC2O4)中碳元素的化合價為+3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣是一種重要化工原料。
(1)德國化學家哈伯從1902年開始研究由氮氣和氫氣直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破壞lmol有關化學鍵需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
則a=_________________。
(2)下圖為不同溫度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]時反應達到平衡時
)]時反應達到平衡時![]() 的轉化率變化曲線。
的轉化率變化曲線。

①![]() 、
、![]() 、
、![]() 、
、![]() 的大小關系為__________________。
的大小關系為__________________。
②保持溫度和體積不變,提高投料比[n(![]() )/n(
)/n(![]() )],則重新達到平衡時,下列說法一定正確的是_______(填字母序號)。
)],則重新達到平衡時,下列說法一定正確的是_______(填字母序號)。
A.![]() 的濃度增大
的濃度增大
B.![]() 的轉化率增大
的轉化率增大
C.![]() 的體積分數增大
的體積分數增大
D.![]() 的濃度減小
的濃度減小
③溫度為![]() 時,向2L密閉容器中加入1.0mol
時,向2L密閉容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反應達到平衡,則用v(
,若5min后反應達到平衡,則用v(![]() )表示該反應的平均速率為____________________;反應在
)表示該反應的平均速率為____________________;反應在![]() 時的平衡常數K=________________。
時的平衡常數K=________________。
(3)一種新型除煙氣中氮氧化物的方法是采用![]() 作還原劑還原煙氣中的氮氧化物且產物無污染,寫出
作還原劑還原煙氣中的氮氧化物且產物無污染,寫出![]() 還原
還原![]() 的化學反應方程式_____________________________________。
的化學反應方程式_____________________________________。
(4)若用標準鹽酸測定某稀氨水的濃度,應選擇__________作指示劑;滴定過程中眼睛注視_____________。已知稀氨水體積為25.0mL,滴定結束測得消耗0.0100mol/L鹽酸的平均體積為20.0mL,則該氨水的濃度為________________(保留2位有效數字);若滴定前滴定管尖嘴有氣泡,滴定后尖嘴無氣泡,則測定結果________(填“偏大”、“偏小”、“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com