
 在一個容積為2L的密閉容器中,加入0.8mol的A2氣體和0.6molB2氣體,一定條件下發生如下反應:A2(g)+B2(g)?2AB(g)△H<0,反應中各物質的濃度隨時間的變化情況如圖所示.
在一個容積為2L的密閉容器中,加入0.8mol的A2氣體和0.6molB2氣體,一定條件下發生如下反應:A2(g)+B2(g)?2AB(g)△H<0,反應中各物質的濃度隨時間的變化情況如圖所示.分析 (1)反應達到平衡時,各物質濃度不再隨時間的變化而變化,根據v=$\frac{△c}{△t}$計算反應速率,;
(2)根據AB的濃度變化計算A2的濃度變化,從而得出a值,化學平衡常數等于生成物濃度冪之積與反應物濃度冪之積的比,根據溫度對化學平衡常數的影響判斷;
(3)上述反應達到平衡后,第4min時,若把容器的體積快速擴大一倍,AB的濃度變為原來的一半,該反應反應前后氣體體積不變,壓強只改變反應速率,不改變平衡移動,據此畫出圖象;
(4)在相同條件下,若開始時向此容器中加入的A2(g)、B2(g)和AB(g)的物質的量分別為0.4mol、0.2mol、0.8mol,在2L容器中有Qc=$\frac{0.{4}^{2}}{0.2×0.1}$=8,根據Qc和Kc的關系判斷平衡移動的方向;將AB(g)全部折算成A2(g)、B2(g)可知,開始時向此容器中加入的A2(g)、B2(g)的物質的量分別為0.8mol、0.6mol與題中的A2(g)、B2(g)的物質的量分別為0.8mol、0.6mol相等,根據等效平衡的原理進行答題.
解答 解:(1)反應達到平衡時,各物質濃度不再隨時間的變化而變化,根據圖可知3min時反應達到平衡狀態,在根據v=$\frac{△c}{△t}$可知,用AB表示的平均反應速率為$\frac{0.5}{3}$mol/(L•min)=$\frac{1}{6}$mol/(L•min),
故答案為:3;$\frac{1}{6}$;
(2)根據圖可知,AB的濃度變化為0.5mol/L,則A2的濃度變化為0.25mol/L,所以a=0.4mol/L-0.25mol/L=0.15mol/L,平衡時的濃度為0.3mol/L-0.25mol/L=0.05mol/L,該反應的化學平衡常數Kc=$\frac{0.{5}^{2}}{0.15×0.05}$=$\frac{100}{3}$,由于該反應是放熱反應,所以溫度升高,平衡逆向移動,Kc值減小,
故答案為:0.15mol/L;$\frac{100}{3}$;減少;
(3)上述反應達到平衡后,第4min時,若把容器的體積快速擴大一倍,AB的濃度變為原來的一半,該反應的反應前后氣體體積不變,壓強只改變反應速率,不改變平衡移動,導致AB的濃度不變,所以其圖象為: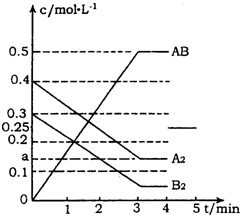 ,
,
故答案為: ;
;
(4)在相同條件下,若開始時向此容器中加入的A2(g)、B2(g)和AB(g)的物質的量分別為0.4mol、0.2mol、0.8mol,在2L容器中有Qc=$\frac{0.{4}^{2}}{0.2×0.1}$=8,Kc=$\frac{100}{3}$,所以Qc<Kc,所以平衡向正反應方向移動,將AB(g)全部折算成A2(g)、B2(g)可知,開始時向此容器中加入的A2(g)、B2(g)的物質的量分別為0.8mol、0.6mol與題中的A2(g)、B2(g)的物質的量分別為0.8mol、0.6mol相等,即兩個平衡為等效平衡,所以各物質的體積分數不變,故選③,
故答案為:正;Qc=$\frac{0.{4}^{2}}{0.2×0.1}$=8,Kc=$\frac{100}{3}$,Qc<Kc,所以平衡向正反應方向移動;③.
點評 本題考查化學反應速率、化學平衡的有關計算、等效平衡等,難度中等,(4)中注意對等效平衡規律的理解,注意該反應特點.


科目:高中化學 來源: 題型:解答題
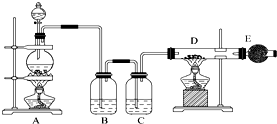 吸收尾氣中未反應的氯氣和防止空氣中水蒸氣進入裝置D.
吸收尾氣中未反應的氯氣和防止空氣中水蒸氣進入裝置D.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 絕熱容器,溫度不再改變 | |
| B. | 恒容時,壓強不在改變 | |
| C. | 恒壓時,體積不在改變 | |
| D. | 斷裂2 mol O-H鍵同時形成1molH-H鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題


 .
. .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤⑥ | B. | ⑤ | C. | ②⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 根據是否具有丁達爾效應,將分散系分為溶液、濁液和膠體 | |
| B. | PM2.5是指大氣中直徑小于或等于2.5微米的顆粒物,也稱為可入肺顆粒物,分散在空氣中不可能形成膠體 | |
| C. | Na2O、Fe2O3、Al2O3既屬于堿性氧化物,又屬于離子化合物 | |
| D. | 氯化鈉固體、液態氯化氫都不導電,都是電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com