
 葡萄可用于釀酒.
葡萄可用于釀酒. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.| ①稱取E4.5g,升溫使其汽化,測其密度是相同條件下H2的45倍. | ①有機物E的相對分子量為90: |
| ②將此9.0gE在足量純O2充分燃燒,并使其產物依次通過堿石灰、無水硫酸銅粉末、足量石灰水,發現堿石灰增重14.2g,硫酸銅粉末沒有變藍,石灰水中有10.0g白色沉淀生成;向增重的堿石灰中加入足量鹽酸后,產生4.48L無色無味氣體(標準狀況). | ②9.0g有機物E完全燃燒時,經計算:生成CO2共為0.3 mol, 生成的H2O5.4g. 有機物E的分子式C3H6O3 |
| ③經紅外光譜測定,證實其中含有羥基,羧基,甲基; | ③E的結構簡式CH3CH(OH)COOH |
分析 (1)葡萄糖含有醛基,與新制氫氧化銅反應生成Cu2O;
(2)葡萄糖在酒化酶作用下生成酒精與二氧化碳;
(3)①乙酸與乙醇在濃硫酸、加熱條件下發生酯化反應生成乙酸乙酯與水;
②試管b中盛放的試劑是飽和碳酸鈉溶液,吸收未反應的乙酸、乙醇,降低乙酸乙酯溶解;
③試管b中的導管直接伸入液面下,裝置內壓強減小,可能發生倒吸危險;
(4)同溫同壓下,氣體密度之比等于其相對分子質量之比,可知有機物相對分子質量為90,該有機物完全燃燒生成二氧化碳與水,堿石灰增重14.2g為生成的水與部分二氧化碳的質量,10.0g白色沉淀為生成的碳酸鈣,產生4.48L無色無味氣體(標準狀況)為堿石灰吸收的二氧化碳的體積,計算10g碳酸鈣、4.48L二氧化碳的物質的量,計算燃燒生成的n(CO2),計算生成的水的質量,再計算水的物質的量根據原子守恒確定分子中C、H原子數目,解相對分子質量計算分子中氧原子數目,進而確定分子式,結合分子式確定其結構簡式.
解答 解:(1)葡萄糖含有醛基,與新制氫氧化銅反應生成Cu2O,產生磚紅色沉淀,故答案為:產生磚紅色沉淀;
(2)葡萄糖在酒化酶作用下生成酒精與二氧化碳,反應方程式為:C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2CO2↑+2C2H5OH,
故答案為:C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2CO2↑+2C2H5OH;
(3)①乙酸與乙醇在濃硫酸、加熱條件下發生酯化反應生成乙酸乙酯與水,反應方程式為:CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案為:CH3COOH+C2H5OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②試管b中盛放的試劑是飽和Na2CO3溶液,吸收未反應的乙酸、乙醇,降低乙酸乙酯溶解,
故答案為:Na2CO3;
③試管b中的導管直接伸入液面下,裝置內壓強減小,可能發生倒吸危險,試管b中的導管不伸入液面下的原因是:防止溶液倒吸,
故答案為:防止溶液倒吸;
(4)①該有機物蒸汽密度是相同條件下H2的45倍,故有機物的相對分子質量為45×2=90,故答案為:90;
②堿石灰增重14.2g為生成的水與部分二氧化碳的質量,10.0g白色沉淀為生成的碳酸鈣,產生4.48L無色無味氣體(標準狀況)為堿石灰吸收的二氧化碳的體積,故堿石灰吸收的二氧化碳的物質的量為$\frac{4.48L}{22.4L/mol}$=0.2mol,碳酸鈣的物質的量為$\frac{10g}{100g/mol}$=0.1mol,故生成的二氧化碳的總的物質的量為0.2mol+0.1mol=0.3mol,生成的水的質量為14.2g-0.2mol×44g/mol=5.4g,水的物質的量為$\frac{5.4g}{18g/mol}$=0.3mol;
有機物E的物質的量為$\frac{9g}{90g/mol}$=0.1mol,故分子中N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.3mol×2}{0.1mol}$=5,則分子中N(O)=$\frac{90-12×3-6}{16}$=3,故有機物E的分子式為C3H6O3,
故答案為:0.3;5.4;C3H6O3;
③經紅外光譜測定,證實其中含有羥基,羧基,甲基,則E的結構簡式為:CH3CH(OH)COOH,
故答案為:CH3CH(OH)COOH;
④E與足量Na的化學方程式:CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑,
故答案為:CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑;
⑤E與NaHCO3溶液反應的化學方程式:HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑,
故答案為:HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑.
點評 本題考查有機物分子式與結構簡式確定、乙酸乙酯制備、官能團的結構與性質等,屬于拼合型題目,掌握燃燒法利用原子守恒確定有機物分子式,難度中等.


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:選擇題
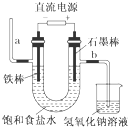
| A. | 裝置中,a管能產生氫氣 | |
| B. | 在石墨棒電極區域有NaOH產物 | |
| C. | b管導出的是氯氣 | |
| D. | 以食鹽水為基礎原料制取氯氣等產品的工業稱為“氯堿工業” |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
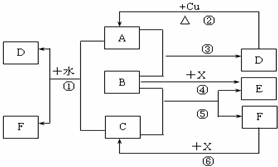
| A. | 溶液①、②等體積混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| B. | 溶液①、②等體積混合,混合液中c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| C. | 溶液①、③等體積混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) | |
| D. | 溶液①、③等體積混合,混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ,下列關于其結構的敘述中,正確的是( )
,下列關于其結構的敘述中,正確的是( )| A. | 甲烷分子是正方形結構 | B. | 甲烷分子是正四面體結構 | ||
| C. | 甲烷分子是極性分子 | D. | 甲烷分子的四個鍵不完全相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
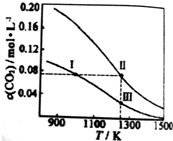
| A. | 反應CO2(g)+c(s)?2CO(g)△H<0 | |
| B. | 反應速率:V逆(狀態Ⅰ)>V逆(狀態Ⅲ) | |
| C. | 體系中c(CO):c(CO,狀態Ⅱ)<2c(CO,狀態Ⅲ) | |
| D. | 體系的壓強:2P總(狀態Ⅰ)>P總(狀態Ⅱ)>P總(狀態Ⅰ) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 室溫下向1 L pH=1的醋酸溶液中加水,所得溶液的H+數目大于0.1NA | |
| B. | 60g乙酸與足量乙醇發生酯化反應,充分反應后斷裂的C-O鍵數目為NA | |
| C. | 某無水乙醇與足量金屬鈉反應生成5.6 L H2,該乙醇分子中共價鍵總數為4 NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0 kI/mol,乙烯與H2加成時放出68.5 kJ熱量,則反應過程中被破壞的碳原子之間共用電子對數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
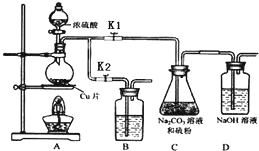 硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得.
硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得.| 編號 | 1 | 2 | 3 |
| 溶液的體積/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2標準溶液的體積/mL | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com