
分析 (1)根據n=cV計算出混合液中含有鐵離子的物質的量;先計算出混合液中氯離子的物質的量,再根據c=$\frac{n}{V}$計算出含有中氯離子的濃度;
(2)加入鐵粉后,鐵離子與鐵反應生成亞鐵離子,然后銅離子與鐵粉反應生成亞鐵離子和銅離子,據此寫出反應的離子方程式.
解答 解:(1)該混合溶液中,Fe3+的物質的量為:n(Fe3+)=cV=2mol/L×0.1L=0.2mol;
氯離子的物質的量等于FeCl3和CuCl2中氯離子物質的量的和,則n(Cl-)=3n(Fe3+)+2n(Cu2+)=0.2mol×3+1mol/L×2×0.1L=0.8mol,
混合溶液中氯離子的物質的量濃度c(Cl-)=$\frac{0.8mol}{0.1L}$=8mol/L,
故答案為:0.2mol;8;
(2)向上述燒杯中加入足量鐵粉并使之充分反應,發生的反應有:①2Fe3++Fe═3Fe2+,②Cu2++Fe═Cu+Fe2+,
故答案為:2Fe3++Fe═3Fe2+;Cu2++Fe═Cu+Fe2+.
點評 本題考查了混合物反應的計算、離子方程式書寫,題目難度中等,明確物質的量與物質的量濃度的關系為解答關鍵,注意掌握常見物質性質及發生反應原理,試題培養了學生的靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| A. | 淀粉溶液、CuO、HClO、Cu | |
| B. | 普通玻璃、H2O、FeCl3、葡萄糖 | |
| C. | 水銀、Na2O、BaSO4、SO3 | |
| D. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | TiCl4溶于大量水加熱制備TiO2 | |
| B. | FeCl3飽和溶液滴入沸水中制Fe(OH)3膠體 | |
| C. | 配制氯化亞鐵溶液時需加少量鐵粉 | |
| D. | 將氯化鋁溶液加熱蒸干并灼燒,最后得到的固體是氧化鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{6}^{14}$C的中子數是8 | |
| B. | ${\;}_{6}^{14}$C與${\;}_{6}^{12}$C互為同位素 | |
| C. | ${\;}_{6}^{14}$C轉化為${\;}_{6}^{12}$C不是化學變化 | |
| D. | ${\;}_{6}^{14}$C與${\;}_{6}^{12}$C互為同素異形體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H6 | D. | C2H2、C3H6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 葡萄可用于釀酒.
葡萄可用于釀酒. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.| ①稱取E4.5g,升溫使其汽化,測其密度是相同條件下H2的45倍. | ①有機物E的相對分子量為90: |
| ②將此9.0gE在足量純O2充分燃燒,并使其產物依次通過堿石灰、無水硫酸銅粉末、足量石灰水,發現堿石灰增重14.2g,硫酸銅粉末沒有變藍,石灰水中有10.0g白色沉淀生成;向增重的堿石灰中加入足量鹽酸后,產生4.48L無色無味氣體(標準狀況). | ②9.0g有機物E完全燃燒時,經計算:生成CO2共為0.3 mol, 生成的H2O5.4g. 有機物E的分子式C3H6O3 |
| ③經紅外光譜測定,證實其中含有羥基,羧基,甲基; | ③E的結構簡式CH3CH(OH)COOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
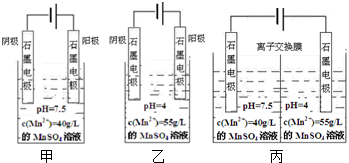
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
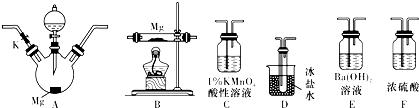
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com