
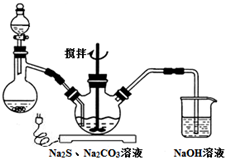
 NaCN為劇毒無機物.某興趣小組查資料得知,實驗室里的NaCN溶液可使用Na2S2O3溶液進行解毒銷毀,他們開展了以下三個實驗,請根據要求回答問題:
NaCN為劇毒無機物.某興趣小組查資料得知,實驗室里的NaCN溶液可使用Na2S2O3溶液進行解毒銷毀,他們開展了以下三個實驗,請根據要求回答問題:分析 Ⅰ.(1)以亞硫酸鈉、硫化鈉和碳酸鈉等為原料、采用下述裝置制備硫代硫酸鈉,根據反應原理可知,蒸餾燒瓶中加入的酸要使反應保持較快的反應速率,濃鹽酸、硝酸都易揮發,而稀鹽酸加入,反應速率較慢,據此答題;
(2)根據題意,Na2S2O3在酸性條件下會生成S,當溶液中pH接近或不小于7時,如果SO2通過量,會生成NaHSO3,據此書寫化學方程式;
(3)從上述生成物混合液中獲得較高產率Na2S2O3?5H2O,在混合液中加入活性碳脫色,然后趁熱過濾,防止溶液中Na2S2O3?5H2O析出,將除去碳后的濾液進行蒸發濃縮、冷卻結晶、抽濾、洗滌、干燥,可得粗晶體,據此答題;
Ⅱ.產品純度的檢測
(4)vmL0.010mol/L碘水溶液中n(I2)=v×10-3L×0.010mol/L=v×10-5mol,根據關系式2Na2 S2O3~I2計算 mg樣品中n(Na2 S2O3),根據m=nM計算mg樣品中Na2 S2O3•5H2O晶體的質量,據此據此純度;
(5)A.錐形瓶未用Na2S2O3溶液潤洗,對實驗結果沒影響;
B.用碘水滴定Na2S2O3溶液,錐形瓶中溶液變藍后立刻停止滴定,進行讀數,則加入的碘水的量不足;
C.滴定終點時仰視讀數,會使讀取的數值偏大;
D.滴定管尖嘴內滴定前無氣泡,滴定終點發現氣泡,則讀出的標準液的體積偏小;
Ⅲ.(6)根據題中實驗現象可知,生成的溶液能使 FeCl3溶液呈現血紅色,說明有SCN-產生,根據電荷守恒和元素守恒可書寫離子方程式.
解答 解:Ⅰ.(1)以亞硫酸鈉、硫化鈉和碳酸鈉等為原料、采用下述裝置制備硫代硫酸鈉,根據反應原理可知,蒸餾燒瓶中加入的酸要使反應保持較快的反應速率,濃鹽酸、硝酸都易揮發,而稀鹽酸加入,反應速率較慢,所以用70%的硫酸,故選C;
(2)根據題意,Na2S2O3在酸性條件下會生成S,當溶液中pH接近或不小于7時,如果SO2通過量,會生成NaHSO3,反應的化學方程式為Na2S2O3+SO2+H2O=2NaHSO3+S↓,
故答案為:Na2S2O3+SO2+H2O=2NaHSO3+S↓;
(3)從上述生成物混合液中獲得較高產率Na2S2O3?5H2O,在混合液中加入活性碳脫色,然后趁熱過濾,防止溶液中Na2S2O3?5H2O析出,將除去碳后的濾液進行蒸發濃縮、冷卻結晶、抽濾、洗滌、干燥,可得粗晶體,所以操作①趁熱過濾,其目的是:趁熱是為了防止晶體在過濾的過程中在漏斗中析出導致產率降低;過濾是為了除去活性炭、硫等不溶性雜質,操作②是蒸發濃縮,冷卻結晶,
故答案為:趁熱是為了防止晶體在過濾的過程中在漏斗中析出導致產率降低;過濾是為了除去活性炭、硫等不溶性雜質;蒸發濃縮,冷卻結晶;
Ⅱ.產品純度的檢測
(4)vmL0.010mol/L碘水溶液中n(I2)=v×10-3L×0.010mol/L=v×10-5mol,則:
2Na2 S2O3~~~~~~~I2
2 1
n(Na2 S2O3) v×10-5mol
所以n(Na2 S2O3)=2×v×10-5mol=2v×10-5mol
Na2 S2O3•5H2O晶體的質量為2v×10-5mol×248g/mol=496v×10-5g.
則該樣品純度為$\frac{496v×10{\;}^{-5}g}{mg}$×100%=$\frac{0.496v}{m}$%,
故答案為:$\frac{0.496v}{m}$%;
(5)A.錐形瓶未用Na2S2O3溶液潤洗,對實驗結果沒影響,故A錯誤;
B.用碘水滴定Na2S2O3溶液,錐形瓶中溶液變藍后立刻停止滴定,進行讀數,則加入的碘水的量不足,會導致實驗結果偏低,故B正確;
C.滴定終點時仰視讀數,會使讀取的數值偏大,則會使實驗結果偏大,故C錯誤;
D.滴定管尖嘴內滴定前無氣泡,滴定終點發現氣泡,則讀出的標準液的體積偏小,會導致實驗結果偏低,故D正確,
故選BD;
Ⅲ.(6)由題中實驗現象可知,生成的溶液能使 FeCl3溶液呈現血紅色,說明有SCN-產生,根據電荷守恒和元素守恒可知共離子方程式為CN-+S2O32-=SCN-+SO32-,
故答案為:CN-+S2O32-=SCN-+SO32-.
點評 本題通過制取Na2S2O3•5H2O的實驗操作,考查了物質制備方案的設計、基本實驗操作、物質純度的計算、滴定誤差分析等,題目難度中等,明確實驗操作與設計及相關物質的性質是解答本題的關鍵,試題充分考查了學生的分析、理解能力及靈活應用所學知識的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向澄清石灰水中加入鹽酸溶液:H++OH-═H2O | |
| C. | 向Ba(OH)2溶液中滴入過量的Na2SO 溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 稀硫酸滴在銅片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
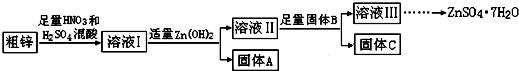
| 物質 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化石能源物質內部蘊涵著大量的能量 | |
| B. | 綠色植物進行光合作用時,將太陽能轉化為化學能“貯存”起來 | |
| C. | 吸熱反應中由于反應物總能量小于生成物總能量,因而沒有利用價值 | |
| D. | 物質的化學能可以在一定條件下轉化為熱能.電能為人類所利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
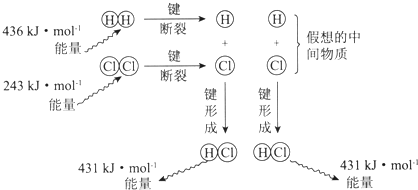
| A. | 該反應的反應熱△H=-183kJ•mol-1 | |
| B. | 該反應生成液態HCl比生成氣態HCl釋放的能量少 | |
| C. | 氯氣分子中的化學鍵比氫氣分子中的化學鍵更穩定 | |
| D. | 1 mol HCl分子中的化學鍵形成時吸收431kJ的能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 容器 編號 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比較 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 兩溶液的導電能力和pH值均相同 | |
| B. | 中和兩溶液,消耗NaOH的物質的量相同 | |
| C. | 分別與足量的Zn完全反應,鹽酸產生的速率快,氫氣多 | |
| D. | 當把兩種酸各10mL混合后,加10mL 0.1mol•L-1的NaOH,則有c(H+)=c(CH3COO-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com