
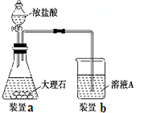
 一段時間后,觀察到燒杯中產生的白色沉淀會逐漸減少.為了避免固體C減少,可采取的改進措施是在裝置I和Ⅱ之間增加一個盛有飽和NaHCO3溶液的洗氣瓶
一段時間后,觀察到燒杯中產生的白色沉淀會逐漸減少.為了避免固體C減少,可采取的改進措施是在裝置I和Ⅱ之間增加一個盛有飽和NaHCO3溶液的洗氣瓶
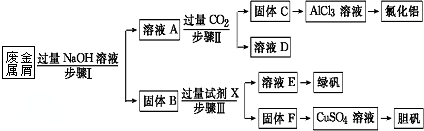
分析 Fe、Cu、Fe2O3都不與NaOH溶液反應,Al和Al2O3可與NaOH溶液反應,用含有Al、Fe、Cu和Al2O3和Fe2O3的廢金屬屑制取AlCl3、綠礬晶體(FeSO4•7H2O)和膽礬晶體流程為:合金中Al、Al2O3與NaOH反應,所得濾液A為NaAlO2溶液,經途徑Ⅱ與足量二氧化碳發生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反應可生成Al(OH)3固體C,生成的Al(OH)3再和鹽酸反應生成AlCl3,得到的AlCl3較純凈;溶液D為NaHCO3溶液;
濾渣B為Fe和Cu的化合物,加入足量稀硫酸,得到的濾液E為FeSO4,經蒸發濃縮、冷卻結晶可得到綠礬,濾渣F為Cu,可用于制備膽礬,據此分析解答.
解答 解:Fe、Cu、Fe2O3都不與NaOH溶液反應,Al和Al2O3可與NaOH溶液反應,用含有Al、Fe、Cu和Al2O3和Fe2O3的廢金屬屑制取AlCl3、綠礬晶體(FeSO4•7H2O)和膽礬晶體流程為:合金中Al、Al2O3與NaOH反應,所得濾液A為NaAlO2溶液,經途徑Ⅱ與足量二氧化碳發生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反應可生成Al(OH)3固體C,生成的Al(OH)3再和鹽酸反應生成AlCl3,得到的AlCl3較純凈;溶液D為NaHCO3溶液;
濾渣B為Fe和Cu的化合物,加入足量稀硫酸,得到的濾液E為FeSO4,經蒸發濃縮、冷卻結晶可得到綠礬,濾渣F為Cu,可用于制備膽礬,
(1)鋁、氧化鋁與氫氧化鈉反應,所得濾液A為NaAlO2溶液,反應的離子方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+H2O,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+H2O;
(2)金屬鐵和金屬銅不與氫氧化鈉反應,金屬銅和稀硫酸之間不反應,但是金屬鐵可以和稀硫酸之間反應生成硫酸亞鐵和氫氣,進而制的綠礬晶體,所以試劑X為稀硫酸;溶液D為NaHCO3溶液,
故答案為:稀硫酸;NaHCO3;
(3)進行步驟Ⅱ時,該小組用如圖2所示裝置及試劑將制得的CO2氣體通入溶液A中.一段時間后,觀察到燒杯中產生的白色沉淀逐漸減少,其原因是二氧化碳氣體中含有從鹽酸中揮發出的HCl氣體,氯化氫在水中溶解了部分沉淀,發生的反應為Al(OH)3+3H+=Al3++3H2O,為了避免固體C減少,可在制取二氧化碳的收集裝置中增加一個洗去HCl的裝置,二氧化碳在飽和NaHCO3中不溶,氯化氫和NaHCO3反應生成二氧化碳氣體,所以可在裝置I和Ⅱ之間增加一個盛有飽和NaHCO3溶液的洗氣瓶,除去二氧化碳中的氯化氫,
故答案為:在裝置I和Ⅱ之間增加一個盛有飽和NaHCO3溶液的洗氣瓶;
(4)溶液E中加入KSCN溶液無明顯現象,表明濾液中不存在Fe3+,原因是Fe3+被Fe、Cu氧化生成Fe2+,所以加入KSCN溶液沒有明顯現象,故答案為:Fe3+被Fe、Cu氧化生成Fe2+;
(5)用固體F繼續加入熱的稀H2SO4,同時不斷鼓入空氣,固體溶解得CuSO4溶液,說明在加熱條件下,Cu、氧氣和稀硫酸發生氧化還原反應生成硫酸銅和水,反應的化學方程式為2Cu+O2+2H2OS4=2CuSO4+2H2O,
故答案為:2Cu+O2+2H2S4=2CuSO4+2H2O;
(6)E為FeSO4,E被雙氧水氧化生成Fe2(SO4)3,然后調節溶液pH,將Fe3+轉化為Fe(OH)3沉淀,將沉淀溶于NaClO、NaOH溶液中得到Na2FeO4,
①測得溶液E中c(Fe2+) 為0.2 mol•L-1,若要處理1 m3溶液E,n(Fe2+)=0.2mol/L×1000L=200mol,
根據轉移電子守恒得n(H2O2)=$\frac{200mol×1}{2}$=100mol,
理論上需要消耗25% 的H2O2溶液質量=100mol×34g/mol÷25%=3400g=13.6kg,
故答案為:13.6;
②由Fe(OH)3制取Na2FeO4的離子方程式為2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-,故答案為:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-.
點評 本題考查物質制備,為高頻考點,涉及氧化還原反應、化學方程式的計算、離子檢驗、基本操作等知識點,明確化學反應原理及物質性質、基本操作是解本題關鍵,知道流程圖中可能存在的反應及基本操作方法,知道每一種物質的成分,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 由H 2(g)、I 2(g)、HI(g)組成的混合氣體平衡體系加壓后顏色加深 | |
| B. | 久置的氯水變成了稀鹽酸 | |
| C. | 在FeCl 3溶液中加入鐵粉防止氧化變質 | |
| D. | 加入催化劑有利于SO 2與O 2反應制SO 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬銅與濃硝酸或稀硝酸反應 | |
| B. | 鈉在常溫或加熱條件與氧氣反應 | |
| C. | 鐵在少量氯氣或過量的氯氣中點燃 | |
| D. | 氯化鋁溶液與少量氫氧化鈉溶液或過量氫氧化鈉溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 只有③ | B. | ②③ | C. | ①③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 證明醋酸的酸性比碳酸強:2CH3COOH+CaCO3═Ca2++H2O+2CH3COO-+CO2↑ | |
| B. | 證明FeCl2溶液已變質:Fe3++3SCN-═Fe(SCN)3 | |
| C. | 證明Al(OH)3有酸性:Al( OH)3+NH3•H2O═AlO2-+NH4++2H2O | |
| D. | 證明氧化性Fe3+>Cu2+:2Fe3++Cu═Cu2++2Fe2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com