
分析 5min時測得N2O5轉化了20%,可知消耗N2O5的物質的量是4mol×20%=0.8mol,則
2N2O5(g)?4NO2(g)+O2(g)
開始 4 0 0
轉化 0.8 1.6 0.4
5min 3.2 1.6 0.4
結合v=$\frac{△c}{△t}$、5min時總物質的量、N2O5的物質的量計算.
解答 解:5min時測得N2O5轉化了20%,可知消耗N2O5的物質的量是4mol×20%=0.8mol,則
2N2O5(g)?4NO2(g)+O2(g)
開始 4 0 0
轉化 0.8 1.6 0.4
5min 3.2 1.6 0.4
(1)5min時,剩余N2O5的物質的量是4mol-0.8mol=3.2mol,
答:剩余N2O5的物質的量為3.2mol;
(2)生成1.6mol二氧化氮,可知v(NO2)=$\frac{\frac{1.6mol}{2L}}{5min}$=0.16mol/(L•min),
答:v(NO2)為0.16mol/(L•min);
(3)5min時混合氣體的總物質的量是3.2+0.4+1.6=5.2mol,N2O5的物質的量占混合氣體總物質的量的百分比為$\frac{3.2mol}{5.2mol}$×100%=61.5%,
答:5min時,N2O5的物質的量占混合氣體總物質的量的百分比為61.5%.
點評 本題考查化學平衡的計算,為高頻考點,把握化學平衡三段法、各物質的量的關系等為解答的關鍵,側重分析與計算能力的考查,注意物質的量分數的計算,題目難度不大.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:選擇題
| A. | 15g甲基(-CH3)所含有的電子數是NA | |
| B. | 常溫常壓下,4g氦氣所含有的原子數目為NA | |
| C. | 標準狀況下,1L正戊烷充分燃燒后生成的氣態產物的分子數為5/22.4 NA | |
| D. | 常溫常壓下,1mol丙烷所含有的共價鍵數目為12NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 容器編號 | 溫度/℃ | 容器體 積/L | 平衡時O2轉化率 | 平衡時 壓強/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反應速率:③>①>② | |
| B. | 平衡時壓強:p1>p2 | |
| C. | 容器體積:V1<V3 | |
| D. | 若實驗②中O2和Cl2用量均加倍,則平衡時O2的轉化率小于70% |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
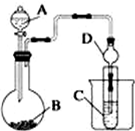 某化學興趣小組為探究元素性質的遞變規律,設計了如下系列實驗.
某化學興趣小組為探究元素性質的遞變規律,設計了如下系列實驗.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
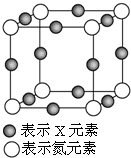 元素X的某價態離子Xn+中所有電子正好充滿K、L、M三個電子層,它與N3-形成的晶體晶胞如圖,則下列說法正確的是( )
元素X的某價態離子Xn+中所有電子正好充滿K、L、M三個電子層,它與N3-形成的晶體晶胞如圖,則下列說法正確的是( )| A. | X元素的原子序數為28 | |
| B. | 晶體中與一個N3-距離最近的Xn+為8個 | |
| C. | Xn+中n的值為1 | |
| D. | 該晶體中N3-與Xn+的個數比為3:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com