
【題目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量與滴入NaOH溶液的體積關系如下圖所示,則原混合液中Al2(SO4)3與MgSO4的物質的量濃度之比為
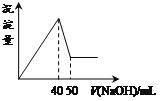
A.1:3B.1:2C.1:1D.2:1
【答案】C
【解析】
首先發生反應Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后發生反應Al(OH)3+OH-═AlO2-+2H2O,由圖可知,溶解Al(OH)3消耗氫氧化鈉溶液的體積為10mL,根據離子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氫氧化鈉溶液的體積為10mL×3=30mL,沉淀Mg2+、Al3+總共消耗氫氧化鈉溶液40mL,計算沉淀Mg2+消耗的氫氧化鈉溶液的體積為40mL-30mL=10mL,則n(Mg2+):n(Al3+)=![]() ×10mL:
×10mL:![]() ×30mL=1:2,故原來混合溶液中Al2(SO4)3和MgSO4的物質的量濃度之比為1:1,故選C。
×30mL=1:2,故原來混合溶液中Al2(SO4)3和MgSO4的物質的量濃度之比為1:1,故選C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】實驗室以工業鈷渣為原料制取CoSO4溶液和ZnSO4·7H2O晶體,其實驗流程如下:
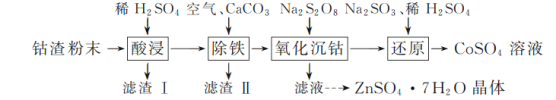
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金屬活動性:Ni介于Fe、Cu之間。③下表是相關金屬離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度1 mol·L-1計算,pH>11時Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
金屬離子 | 開始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Zn2+ | 5.9 | 8.9 |
(1)“酸浸”時所加稀硫酸不宜過量太多的原因是________。
(2)“除鐵”時,向溶液中持續鼓入空氣的作用是________。
(3)流程中需將濾渣Ⅰ、濾渣Ⅱ的洗滌液與“除鐵”后所得濾液合并,目的是________。
(4)寫出“還原”過程中Na2SO3、稀H2SO4與Co(OH)3反應的離子方程式:________。
(5)實驗所得CoSO4溶液可用于制備CoCO3,制備時CoSO4飽和溶液與Na2CO3飽和溶液的混合方式為________。
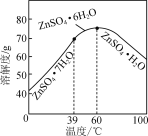
(6)請結合如圖硫酸鋅晶體的溶解度曲線,設計從“氧化沉鈷”后的濾液(含ZnSO4、Na2SO4、NiSO4等)中獲取ZnSO4·7H2O的實驗方案:取適量濾液,____________________________,過濾,用少量冰水洗滌,低溫干燥得ZnSO4·7H2O晶體。(實驗中須使用的試劑有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容條件下,反應:2SO2 (g) + O2 (g) ![]() 2SO3(g) ΔH =-QkJ·mol-1。在上述條件下分別充入的氣體和反應放出的熱量 ( Q>0 )如下表所列:
2SO3(g) ΔH =-QkJ·mol-1。在上述條件下分別充入的氣體和反應放出的熱量 ( Q>0 )如下表所列:
容器 | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根據以上數據,下列敘述正確的是( )
A. 在上述條件下反應生成lmol SO3固體放熱Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應的實驗,能達到實驗目的的是( )
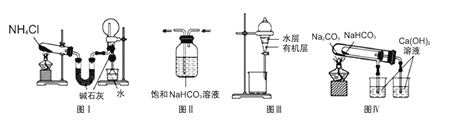
A.圖I用于實驗室制取氨氣并收集干燥的氨氣
B.圖II用于除去CO2中含有的少量HCl
C.圖III用于提取I2的CCl4溶液中的I2
D.圖IV裝置用于驗證NaHCO3和Na2CO3的熱穩定性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉(Na2S2O3),又名大蘇打、海波,它是無色透明的單斜晶體,熔點48℃。硫代硫酸鈉(Na2S2O3)可作為照相業的定影劑,反應原理為AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。
Ⅰ.為了從廢定影液中提取 AgNO3,設計如下實驗流程。
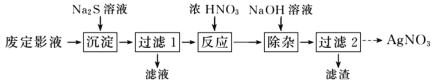
(1)“沉淀”步驟中生成 Ag2S 沉淀,檢驗沉淀完全的操作是________。
(2)“反應”步驟中會生成淡黃色固體,該反應的化學方程式為________。
(3)“過濾 2”的溶液獲取 AgNO3晶體的操作是蒸發濃縮、冷卻結晶、________、________、干燥。
Ⅱ.下圖是實驗室模擬工業制備 Na2S2O3 的裝置圖。
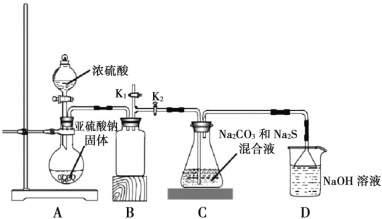
依據圖示回答下列問題:
(4)裝置 A 中盛放亞硫酸鈉固體的玻璃儀器名稱是________,裝置 B 的作用是________。
(5)分液漏斗中如直接用 98%的濃硫酸,燒瓶中固體易產生“結塊”現象,使反應速率變慢。產生“結塊”現象的原因是________。
(6)設置 K1導管的目的是為了防止拆除裝置時造成空氣污染。請簡述操作方法________。
(7)硫代硫酸鈉還可用于除去鞣制皮革時過量的重鉻酸鹽,將其還原成 Cr3+,理論上處理1mol Cr2O72-需要 Na2S2O3的質量為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】降冰片二烯類化合物是一類太陽能儲能材料,降冰片二烯在紫外線照射下可以發生下列轉化。下列說法錯誤的是

A.四環烷的一氯代物超過三種(不考慮立體異構)
B.降冰片二烯能使酸性高錳酸鉀溶液褪色
C.降冰片二烯與四環烷互為同分異構體
D.降冰片二烯分子中位于同一平面的碳原子不超過4個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①正丁醇沸點:117.2℃,正丁醛沸點:75.7℃;②正丁醇合成正丁醛的反應:![]() ,裝置如圖。下列說法不正確的是
,裝置如圖。下列說法不正確的是

A.為防止產物進一步氧化,應將適量Na2Cr2O7酸性溶液逐滴加入正丁醇中
B.向分餾出的餾出物中加入少量金屬鈉,可檢驗其中是否含有正丁醇
C.當溫度計1示數為90~95℃,溫度計2示數在76℃左右時收集產物
D.向分離所得的粗正丁醛中,加入無水CaCl2固體,過濾,蒸餾,可提純正丁醛
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科技工作者設計了一種電解裝置,能將甘油(C3H8O3)和二氧化碳轉化為甘油醛(C3H6O3)和合成氣,原理如圖所示。下列說法正確的是
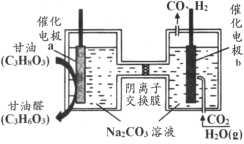
A.催化電極b與電源正極相連
B.電解時催化電極a附近的pH增大
C.電解時陰離子透過交換膜向a極遷移
D.生成的甘油醛與合成氣的物質的量相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cl2是一種重要的化工原料,結合氯氣的相關知識解決下列問題:
(1)少量Cl2也可以由以下反應制取,配平方程式:____ KMnO4 + ____ HCl(濃) =____ KCl + ____ MnCl2 + ____ Cl2↑ + ____ H2O;若上述反應中產生0.1molCl2,則轉移的電子數為___________。
(2)工業上常用廉價的石灰乳吸收工業氯氣尾氣制得漂白粉,該反應的化學方程式是: _________________________________,所得漂白粉的有效成分是______________________(填物質名稱)。
(3)用如圖所示裝置進行氯氣的性質實驗,裝置A、B、C中的試劑依次為: FeCl2溶液、淀粉KI溶液、石蕊溶液(圖中夾持裝置已略去)

請回答下列問題:
①A溶液由淺綠色變為棕黃色,反應的離子方程式為:____________________________________;
②B瓶中的淀粉KI溶液變__________色,反應的離子方程式為:_____________________________________;
③C瓶中的觀察到的現象為:_________________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com