
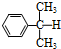
 )氧化法是工業生產苯酚和丙酮最主要的方法.其反應和流程如下:
)氧化法是工業生產苯酚和丙酮最主要的方法.其反應和流程如下: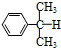 +O→
+O→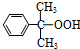 (異丙苯過氧氫)
(異丙苯過氧氫)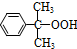 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$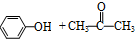 (丙嗣)
(丙嗣)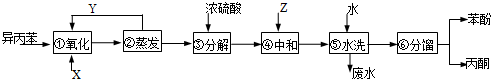
| 物質 | 丙酮 | 苯酚 | 異丙苯 |
| 密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
| 沸點/°C | 56.5 | 182 | 153 |
 ,產品T是丙酮,
,產品T是丙酮, ;第1加鹽酸、第②步加KI溶液,要迅速蓋好蓋子的原因是溴易揮發.
;第1加鹽酸、第②步加KI溶液,要迅速蓋好蓋子的原因是溴易揮發.分析 用異丙苯氧化法生產苯酚和丙酮,由給予的反應信息,異丙苯與氧氣在反應器①中發生氧化反應生成 ,在②中蒸發分離出
,在②中蒸發分離出 ,未反應的異丙苯進行循環利用,
,未反應的異丙苯進行循環利用, 在③中在濃硫酸作催化劑條件下分解得到
在③中在濃硫酸作催化劑條件下分解得到 、
、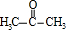 ,在④中加入Z,目的是中和硫酸,且不能與苯酚反應,可以是碳酸氫鈉,然后⑤中水洗滌,再經過⑥分餾得丙酮、苯酚,據此答題.
,在④中加入Z,目的是中和硫酸,且不能與苯酚反應,可以是碳酸氫鈉,然后⑤中水洗滌,再經過⑥分餾得丙酮、苯酚,據此答題.
解答 解:用異丙苯氧化法生產苯酚和丙酮,由給予的反應信息,異丙苯與氧氣在反應器①中發生氧化反應生成 ,在②中蒸發分離出
,在②中蒸發分離出 ,未反應的異丙苯進行循環利用,
,未反應的異丙苯進行循環利用, 在③中在濃硫酸作催化劑條件下分解得到
在③中在濃硫酸作催化劑條件下分解得到 、
、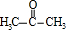 ,在④中加入Z,目的是中和硫酸,且不能與苯酚反應,可以是碳酸氫鈉,然后⑤中水洗滌,再經過⑥分餾得丙酮、苯酚,
,在④中加入Z,目的是中和硫酸,且不能與苯酚反應,可以是碳酸氫鈉,然后⑤中水洗滌,再經過⑥分餾得丙酮、苯酚,
(1)根據上面的分析可知,X物質是 氧氣(或空氣);Y物質是 異丙苯,
故答案為:氧氣(或空氣);異丙苯;
(2) 在③中在濃硫酸作催化劑條件下分解得到
在③中在濃硫酸作催化劑條件下分解得到 、
、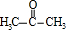 ,所以濃硫酸的作用是 催化劑,其優點是用量少,可能的缺點是 濃硫酸會使有機物發生脫水等副反應(濃硫酸與有機物混合放出大量熱,使反應溫度過高,不利于反應進行;或濃硫酸會腐蝕設備等),
,所以濃硫酸的作用是 催化劑,其優點是用量少,可能的缺點是 濃硫酸會使有機物發生脫水等副反應(濃硫酸與有機物混合放出大量熱,使反應溫度過高,不利于反應進行;或濃硫酸會腐蝕設備等),
故答案為:催化劑;濃硫酸會使有機物發生脫水等副反應(濃硫酸與有機物混合放出大量熱,使反應溫度過高,不利于反應進行;或濃硫酸會腐蝕設備等);
(3)根據上面的分析可知,Z可以是碳酸氫鈉,故選c;
(4)步驟⑥分餾中,由于丙酮的沸點低于苯酚,則T為丙酮、P為苯酚,
故答案為:丙酮; 丙酮的沸點低;
(5)苯酚與濃溴水反應的化學方程式為 ,由于溴易揮發,所以第1加鹽酸、第②步加KI溶液,要迅速蓋好蓋子,防止溴揮發,
,由于溴易揮發,所以第1加鹽酸、第②步加KI溶液,要迅速蓋好蓋子,防止溴揮發,
故答案為: ;溴易揮發;
;溴易揮發;
(6)溶液中有淀粉,當達到滴定終點時,碘反應完全,所以滴定終點的現象是 由藍色變為無色(或白色渾濁)且半分鐘內不變色;
20mLKBrO3和KBr混合溶液[其中:c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于錐形瓶中,再加入10mL6mol/L的鹽酸,根據方程式BrO3-+5Br-+6H+→3Br2+3H2O可知,生成的溴的物質的量為3×0.0100mol/L×0.02L=6×10-4 mol,根據反應I2+2Na2S2O3→2NaI+Na2S4O6可知,由溴與碘化鉀反應生成的碘的物質的量為0.0250mol/L×0.02248L×$\frac{1}{2}$=2.81×10-4 mol,所以與苯酚反應的溴的物質的量為6×10-4 mol-2.81×10-4 mol=3.19×10-4 mol,根據反應 可知,苯酚的物質的量為3.19×10-4 mol×$\frac{1}{3}$=1.06×10-4 mol,所以廢水中苯酚的濃度是$\frac{1.06×1{0}^{-4}mol}{0.02L}$=0.0053mol/L,
可知,苯酚的物質的量為3.19×10-4 mol×$\frac{1}{3}$=1.06×10-4 mol,所以廢水中苯酚的濃度是$\frac{1.06×1{0}^{-4}mol}{0.02L}$=0.0053mol/L,
故答案為:由藍色變為無色(或白色渾濁)且半分鐘內不變色;0.0053.
點評 本題考查有機物的制備實驗方案,涉及對化學工藝流程、裝置及試劑的分析評價等,關鍵是根據實驗目的與給予的反應信息理解工藝流程原理,是對學生綜合能力的考查,難度中等.


 名校通行證有效作業系列答案
名校通行證有效作業系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2mol•L-1 | B. | 0.5mol•L-1 | C. | 1mol•L-1 | D. | 3mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 右圖是用點滴板探究氨氣的性質.實驗時向NaOH固體上滴幾滴濃氨水后,立即用培養皿罩住整個點滴板.下列對實驗現象的解釋正確的是( )
右圖是用點滴板探究氨氣的性質.實驗時向NaOH固體上滴幾滴濃氨水后,立即用培養皿罩住整個點滴板.下列對實驗現象的解釋正確的是( )| 選項 | 實驗現象 | 解釋 |
| A | 紅色石蕊試紙變藍 | NH3極易溶于水 |
| B | 濃硫酸附近無白煙 | NH3與濃硫酸不發生反應 |
| C | 氯化鋁溶液變渾濁 | NH3與AlCl3溶液反應:Al3++3OH-→Al(OH)3↓ |
| D | 濃鹽酸附近有白煙 | NH3與揮發出的HCl反應:NH3+HCl→NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 太陽能電池是通過光電效應或者光化學效應直接把光能轉化成電能的裝置.其材料除單晶硅,還有銅銦鎵硒等化合物.
太陽能電池是通過光電效應或者光化學效應直接把光能轉化成電能的裝置.其材料除單晶硅,還有銅銦鎵硒等化合物.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 維生素和淀粉遇碘水均顯藍色 | |
| B. | 蛋白質、乙酸和葡萄糖均屬電解質 | |
| C. | 溴乙烷與NaOH乙醇溶液共熱生成乙烯 | |
| D. | 乙酸乙酯和食用植物油均可水解生成乙醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應后溶液可能呈中性 | |
| B. | 反應停止后一定有固體剩余 | |
| C. | 反應過程中一定有氧化還原反應發生 | |
| D. | 若只有Cu剩余,向溶液中滴入鐵氰化鉀溶液不會產生藍色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗裝置 | 編號 | 溶液X | 實驗現象 |
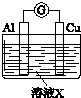 | 實驗Ⅰ | 6mol•L-1稀硝酸 | 電流計指針向右偏轉,銅片表面產生無色氣體,在液面上方變為紅棕色. |
| 實驗Ⅱ | 15mol•L-1濃硝酸 | 電流計指針先向右偏轉,很快又偏向左邊,鋁片和銅片表面產生紅棕色氣體,溶液變為綠色. |
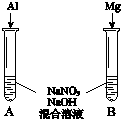 (3)用如圖裝置進行實驗Ⅲ:溶液X為1mol•L-1稀硝酸溶液,觀察到電流計指針向右偏轉.
(3)用如圖裝置進行實驗Ⅲ:溶液X為1mol•L-1稀硝酸溶液,觀察到電流計指針向右偏轉.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com