

分析 (1)依據圖象分析計算C生成的物質的量,結合反應速率概念計算;
(2)依據圖象變化分析,t2時刻逆反應速率不變,正反應速率增大,平衡正向進行,改變的條件是增大反應物質的濃度;t5時刻正逆反應速率都增大,且平衡正向進行,依據選項分析說明改變的條件可能是升高溫度,反應是吸熱反應;
(3)C為生成物,C的物質的量最大說明平衡正向進行程度最大,所以t6時刻以后C物質的量最高;
(4)依據甲圖象分析,A為反應物,C為生成物,計算變化的物質的量濃度,分析乙圖象中改變的條件t3~t4階段與t4~t5階段正逆反應速率都相等,而t3~t4階段為使用催化劑,則t4~t5階段應為減小壓強,則該反應中氣體的化學計量數之和前后相等,則B為生成物,結合t5~t6階段平衡正向進行,改變的是溫度結合移動原理判斷反應能量變化;
(5)根據C、A濃度的變化判斷二者計量數關系,根據t4~t5階段判斷化學方程式,根據化學方程式計算.
解答 解:(1)甲圖中從反應至達到平衡狀態,生成物C的平均反應速率=$\frac{\frac{0.22mol-0.1mol}{2L}}{15s}$=0.004mol•L-1•s-1;
故答案為:0.004mol•L-1•s-1;
(2)t2時刻逆反應速率不變,正反應速率增大,平衡正向進行,改變的條件是增大反應物質的濃度;結合t5~t6階段平衡正向進行,改變的是溫度,正逆反應速率增大,說明改變的條件是升溫;
故答案為:增大反應物濃度;升溫;
(3)C為生成物,C的物質的量最大說明平衡正向進行程度最大,所以t6時刻平衡正向進行,t6時刻以后C物質的量最高;
故答案為:t5~t6;
(4)反應中A的濃度變化為0.15mol/L-0.06mol/L=0.09mol/L,C的濃度變化為0.11mol/L-0.05mol/L=0.06mol/L,反應中A與C的計量數之比為0.09:0.06=3:2,t3~t4階段與t4~t5階段正逆反應速率都相等,而t3~t4階段為使用催化劑,則t4~t5階段應為減小壓強,則該反應中氣體的化學計量數之和前后相等,則有:3A(g)?B(g)+2C(g),t5~t6階段平衡正向進行,改變的是溫度,升溫平衡正向進行說明反應式吸熱反應;
故答案為:3A(g)?B(g)+2C(g);吸熱;
(5)反應中A的濃度變化為0.15mol/L-0.06mol/L=0.09mol/L,C的濃度變化為0.11mol/L-0.05mol/L=0.06mol/L,反應中A與C的計量數之比為0.09:0.06=3:2,t3~t4階段與t4~t5階段正逆反應速率都相等,而t3~t4階段為使用催化劑,則t4~t5階段應為減小壓強,則該反應中氣體的化學計量數之和前后相等,則有:3A(g)?B(g)+2C(g),根據方程式可知消耗0.09mol/L的A,則生成0.03mol/L的B,容器的體積為2L,生成B的物質的量為0.06mol,平衡時B的物質的量為0.1mol,所以起始時B的物質的量為0.1mol-0.06mol=0.04mol;
故答案為:0.04mol.
點評 本題考查化學平衡移動圖象題,題目難度較大,注意從乙圖判斷各階段的影響因素,此為解答該題的關鍵.


 口算小狀元口算速算天天練系列答案
口算小狀元口算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.0021g | B. | 0.021g | C. | 0.21g | D. | 2.1g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 少量Mg(OH)2固體可溶于較濃的NH4Cl溶液中:Mg(OH)2+2NH4+═Mg2++2NH3•H2O | |
| B. | 在CuSO4溶液中加入PbS,可轉變為銅藍(CuS):Cu2++PbS═Pb2++CuS | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 向Na2S2O3溶液中滴加稀硫酸,溶液變混濁:S2O32-+2H+═S↓+SO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
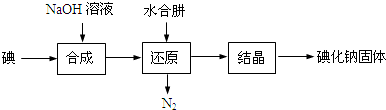
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 實驗室采用圖①所示裝置收集SO2 | |
| B. | 用圖②所示裝置,分離CCl4萃取I2水后的有機層和水層 | |
| C. | 除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后過濾 | |
| D. | 稱取0.40gNaOH,放入100mL容量瓶中,配制0.10mol•L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
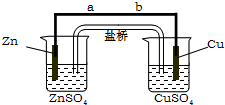 某學生利用下面實驗裝置探究鹽橋式原電池的工作原理.按照實驗步驟依次回答下列問題:
某學生利用下面實驗裝置探究鹽橋式原電池的工作原理.按照實驗步驟依次回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
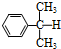 )氧化法是工業生產苯酚和丙酮最主要的方法.其反應和流程如下:
)氧化法是工業生產苯酚和丙酮最主要的方法.其反應和流程如下: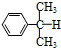 +O→
+O→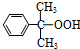 (異丙苯過氧氫)
(異丙苯過氧氫)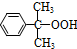 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$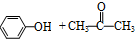 (丙嗣)
(丙嗣)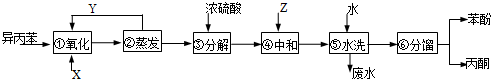
| 物質 | 丙酮 | 苯酚 | 異丙苯 |
| 密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
| 沸點/°C | 56.5 | 182 | 153 |
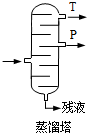 ,產品T是丙酮,
,產品T是丙酮, ;第1加鹽酸、第②步加KI溶液,要迅速蓋好蓋子的原因是溴易揮發.
;第1加鹽酸、第②步加KI溶液,要迅速蓋好蓋子的原因是溴易揮發.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
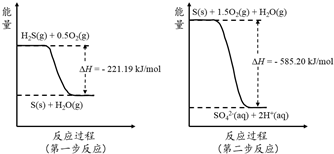
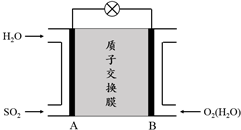
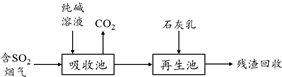
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com