
 研究NO2、SO2.CO等大氣污染氣體的處理具有重要意義.
研究NO2、SO2.CO等大氣污染氣體的處理具有重要意義.分析 (1)NO2可用水吸收發生的化學反應是二氧化氮和水反應生成硝酸和一氧化氮,根據化合價的變化結合方程式計算;
(2)利用蓋斯定律計算反應熱,得到平衡狀態時,正逆反應速率相等,各物質的濃度不變,由此衍生的一些物理量也不變,計算平衡時各物質的濃度,可計算平衡常數;
(3)利用化學平衡的影響因素和工業生產的關系來分析.
解答 解:(1)二氧化氮和水反應生成硝酸和一氧化氮,反應的化學方程式為:3NO2+H2O=2HNO3+NO,反應6NO2+8NH3$\frac{\underline{催化劑}}{△}$7N2+12H2O中,6NO2中N元素化合價降低,由+4價降低到0價,則6molNO2參加反應,轉移24mol電子,所以當轉移1.2mol電子時,消耗NO20.3mol,體積為6.72L,
故答案為:3NO2+H2O=2HNO3+NO,6.72;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1,利用蓋斯定律將①×$\frac{1}{2}$-②×$\frac{1}{2}$得NO2(g)+SO2(g)?SO3(g)+NO(g)
△H=$\frac{1}{2}$×(-196.6kJ•mol-1)-$\frac{1}{2}$×(-113.0kJ•mol-1)=-41.8kJ•mol-1,
A.無論是否達到平衡,體系壓強都保持不變,不能用于判斷是否達到平衡狀態,故A錯誤;
B.混合氣體顏色保持不變,說明濃度不變,達到平衡狀態,故B正確;
C.SO3和NO的計量數之比為1:1,無論是否達到平衡,二者的體積比保持不變,不能判斷是否達到平衡狀態,故C錯誤;
D.物質的量之比等于化學計量數之比,則每消耗1mol SO3的同時生成1molNO2,不能判斷是否達到平衡狀態,故D錯誤.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物質的體積 a 2a 0 0
轉化物質的體積 x x x x
平衡物質的體積 a-x 2a-x x x
平衡時NO2與SO2體積比為1:6,即(1a-x):(2a-x)=1:6,故x=$\frac{4}{5}$a,故平衡常數K=$\frac{c(S{O}_{3})c(NO)}{c(N{O}_{2})c(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{\frac{16}{25}{a}^{2}}{\frac{1}{5}a×\frac{6}{5}a}$=$\frac{8}{3}$,
故答案為:-41.8;B;$\frac{8}{3}$;
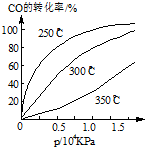
(3)由圖可知,溫度升高,CO的轉化率降低,平衡向逆反應方向移動,故逆反應是吸熱反應,正反應是放熱反應,△H<0;壓強大,有利于加快反應速率,有利于使平衡正向移動,但壓強過大,需要的動力大,對設備的要求也高,故選擇250℃、1.3×104kPa左右的條件.因為在250℃、壓強為1.3×104 kPa時,CO的轉化率已較大,再增大壓強,CO的轉化率變化不大,沒有必要再增大壓強.
故答案為:<,在1.3×104kPa下,CO的轉化率已較高,再增大壓強CO的轉化率提高不大,而生產成本增加得不償失.
點評 本題以NO2、SO2、CO等物質為載體,綜合考查化學平衡移動、蓋斯定律以及平衡常數的計算等問題,側重于學生綜合運用化學知識的能力的考查,題目難度中等.


 優學名師名題系列答案
優學名師名題系列答案科目:高中化學 來源: 題型:多選題
| A. | SiO2與CO2相似,由一個硅原子和兩個氧原子構成一個SiO2分子 | |
| B. | 硅酸鹽一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| C. | SiO2是酸性氧化物,能和堿反應,不能和酸反應 | |
| D. | 硅元素是構成礦物巖石的主要成分之一,其化合態幾乎全部是氧化物和硅酸鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 陽極反應為Fe-2e-═Fe2+ | |
| B. | 電路中每轉移12mol電子,最多有1molCr2O${\;}_{7}^{2-}$被還原 | |
| C. | 過程中有Fe(OH)3沉淀生成 | |
| D. | 電解過程中溶液pH不會變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
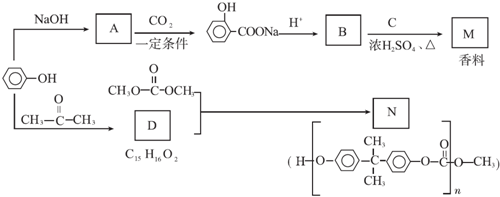
 .
. ;
; +
+ $?_{△}^{濃硫酸}$
$?_{△}^{濃硫酸}$ +H2O.
+H2O.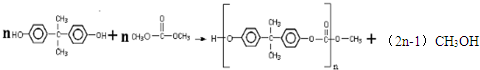 ,反應類型為縮聚反應.
,反應類型為縮聚反應.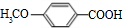 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 壓強/MPa 體積分數/% 溫度/℃ | 1.0 | 2.0 | 3.0 |
| 350 | 54.0 | a | b |
| 415 | c | 40.0 | d |
| 550 | e | f | 36.0 |
| A. | b>e | B. | 415℃、2.0MPa時B的轉化率為60% | ||
| C. | 該反應的△H>0 | D. | 平衡常數K(550℃)>K(350℃) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 現象 | 結論 |
| A | 分別加熱Na2CO3和NaHCO3固體 | 試管內壁都有水珠 | 兩種物質均受熱分解 |
| B | 加熱盛有NH4Cl固體的試管 | 試管底部固體消失,試管口有晶體凝結. | NH4Cl固體可以升華 |
| C | 向含I-的無色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液變成藍色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液變成血紅色 | Fe2+既有氧化性又有還原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.4g金屬鎂變為鎂離子時所含電子數為NA | |
| B. | 1mol•L-1的A1Cl3溶液中,Cl-離子的數目為3NA | |
| C. | 標準狀況下,22.4LSO3含有的分子數為NA | |
| D. | 常溫常壓下,16g O2和O3的混合氣體所含分子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0 溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑤ | B. | 只有①②③⑥ | C. | ②③④⑤ | D. | 只有①③⑤⑥ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com