
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 200 mL 0.4 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1.6 mol•L-1NaCl溶液 | D. | 25 mL 0.8 mol•L-1HCl溶液 |
分析 氯離子的物質的量濃度與溶液體積大小無關,與溶質濃度及溶質化學式組成有關,如:100mL 0.8mol•L-1NaCl溶液所含的Cl-物質的量濃度為:0.8mol/L×1=0.8mol/L,據此進行解答.
解答 解:100mL 0.8mol•L-1NaCl溶液所含的Cl-物質的量濃度為:0.8mol/L×1=0.8mol/L,
A.100 mL 0.8 mol•L-1MgCl2溶液中氯離子的物質的量濃度為:0.8mol/L×2=1.6mol/L,故A錯誤;
B.200 mL 0.4 mol•L-1AlCl3溶液中氯離子的濃度為:0.4mol/L×3=1.2mol/L,故B錯誤;
C.50 mL 1.6 mol•L-1NaCl溶液中氯離子的濃度為:1.6mol/L×1=1.6mol/L,故C錯誤;
D.25mL 0.8 mol•L-1HCl溶液中氯離子的濃度為:0.8mol/L×1=0.8mol/L,故D正確;
故選D.
點評 本題考查了物質的量濃度計算,題目難度不大,明確物質的量濃度的概念及表達式為解答關鍵,注意氯離子的濃度與溶液體積大小無關,為易錯點,試題培養了學生的化學計算能力.


 快樂暑假暑假能力自測中西書局系列答案
快樂暑假暑假能力自測中西書局系列答案科目:高中化學 來源: 題型:選擇題
| A. | 原子序數:W>X>Y>Z | B. | 原子半徑:W>X>Y>Z | ||
| C. | W的最高價氫氧化物的堿性比X弱 | D. | Y的最簡單氫化物的穩定性比Z的強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生活中常用的塑料制品及橡膠制品都為高分子材料 | |
| B. | 向牛奶中加入果汁會產生沉淀,這是因為酸堿發生了中和反應 | |
| C. | 節日焰火是某些金屬元素焰色反應所呈現出來的色彩 | |
| D. | 可用蘸濃鹽酸的棉棒檢驗輸送氨氣的管道是否漏氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在7.8gNa2O2晶體中陽離子與陰離子總數為0.3NA | |
| B. | 在KIO3+6HI=KI+3I2+3H2O反應中,每生成3mol I2,則轉移6NA個電子 | |
| C. | 1mol Na2O2與H2O完全反應,轉移的電子總數為NA | |
| D. | 在1L0.1mol/L的碳酸鈉溶液中,陰離子總數大于0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 物質 | 試劑 | 分離方法 | |
| A | 硝酸鉀(氯化鈉) | 蒸餾水 | 降溫結晶 |
| B | 二氧化碳(氯化氫) | 飽和碳酸鈉溶液 | 洗氣 |
| C | 乙醇(水) | 生石灰 | 蒸餾 |
| D | 氫氧化鈉(氫氧化鋇) | 稀硫酸 | 過濾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液中:NH4+、Ag+、PO43-、Cl- 能大量共存 | |
| B. | 水電離產生的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl?、Br-一定能大量共存 | |
| C. | 使紫色石蕊試液變紅的溶液:Fe2+、Mg2+、NO3-、Cl-能大量共存 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將AlCl3溶液加熱蒸干可得無水AlCl3 | |
| B. | 用25ml堿式滴定管量出14.80ml的碳酸鈉溶液 | |
| C. | 在中和滴定的實驗過程中,目光只應注視滴定管的液面 | |
| D. | 用蒸餾水濕潤過的pH試紙測0.1mol/L的醋酸溶液的pH值 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將分別蘸有濃硝酸和濃氨水的玻璃棒相互靠近時,有白煙生成 | |
| B. | 硝酸具有酸的通性,如果與活潑金屬反應,會有H2生成 | |
| C. | 濃硝酸能使活潑金屬如鋁、鎂、鋅、鐵等發生“鈍化” | |
| D. | 常溫下,銅與稀HNO3反應很慢,是因為發生了“鈍化” |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
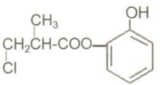
| A. | 有機物A與濃硫酸混合加熱,可以發生消去反應 | |
| B. | 1molA和足量的H2發生加成反應,最多可以消耗4molH2 | |
| C. | 1molA和足量NaOH溶液發生反應,最多可以消耗 4molNaOH | |
| D. | 有機物A不能在稀硫酸下水解 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com