
| A. | 將分別蘸有濃硝酸和濃氨水的玻璃棒相互靠近時,有白煙生成 | |
| B. | 硝酸具有酸的通性,如果與活潑金屬反應,會有H2生成 | |
| C. | 濃硝酸能使活潑金屬如鋁、鎂、鋅、鐵等發生“鈍化” | |
| D. | 常溫下,銅與稀HNO3反應很慢,是因為發生了“鈍化” |
分析 A.均易揮發,二者反應生成硝酸銨固體;
B.硝酸屬于氧化性酸,它與活潑金屬反應不會生成H2;
C.常溫下,濃硝酸能使鋁、鐵等表面氧化生成致密的氧化物保護膜,阻止內部金屬繼續反應,但是鎂、鋅等是沒有此現象的;
D.銅不會發生鈍化.
解答 解:A.將分別蘸有濃硝酸和濃氨水的玻璃棒相互靠近時,均易揮發,二者反應生成硝酸銨固體,觀察到有白煙生成,故A正確;
B.硝酸屬于氧化性酸,它與活潑金屬反應不會生成H2,一般生成氮的氧化物,故B錯誤;
C.常溫下,濃硝酸能使鋁、鐵等表面氧化生成致密的氧化物保護膜,阻止內部金屬繼續反應,但是鎂、鋅等是沒有此現象的,則濃硝酸能使活潑金屬如鋁、鐵發生“鈍化”現象,故C錯誤;
D.常溫下,銅與稀HNO3反應很慢,與金屬活潑性,硝酸的濃度等有關,銅不會發生鈍化,故D錯誤;
故選A.
點評 本題考查物質的性質及反應,為高考常見題型,側重于學生的分析能力和應用能力的考查,把握物質的性質、濃度與反應的關系為解答的關鍵,注意鈍化的理解與應用,題目難度不大.


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:填空題
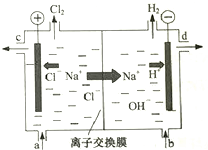 氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品.如圖是離子交換膜法電解食鹽水的示意圖,圖中的離子交換膜只允許陽離子通過.完成下列填空:
氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品.如圖是離子交換膜法電解食鹽水的示意圖,圖中的離子交換膜只允許陽離子通過.完成下列填空:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 200 mL 0.4 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1.6 mol•L-1NaCl溶液 | D. | 25 mL 0.8 mol•L-1HCl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
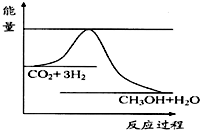 由于溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引起了各國的普遍重視.目前工業上有一種方法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如圖表示該反應進行過程中能量(單位為kJ•mol-1)的變化.
由于溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引起了各國的普遍重視.目前工業上有一種方法是用CO2生產燃料甲醇.一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如圖表示該反應進行過程中能量(單位為kJ•mol-1)的變化.查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
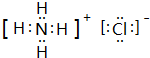 ;I分子的空間構型為直線形.
;I分子的空間構型為直線形.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
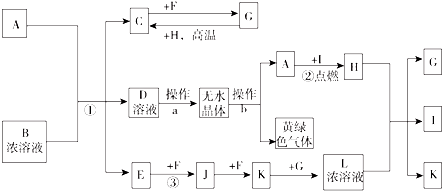
 在圖所示物質的轉化關系中,D在常溫下為無色無味的液體(反應條件均已省略).請回答下列問題:
在圖所示物質的轉化關系中,D在常溫下為無色無味的液體(反應條件均已省略).請回答下列問題: .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
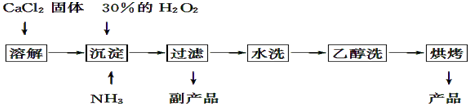
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:3 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com