
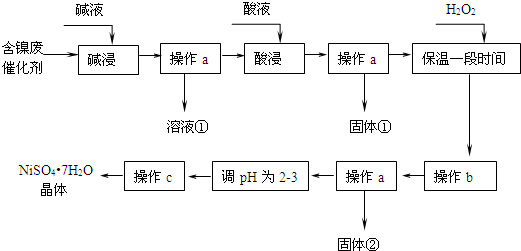
| 沉淀物 | 開始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
分析 (1)根據廢料成分知,堿和鋁、氧化鋁反應,溶液中含有偏鋁酸根離子;
(2)根據數據表知,應將亞鐵離子轉化成鐵離子除去,加入雙氧水氧化亞鐵離子生成鐵離子,不引入新雜質.用漂白液(主要成分次氯酸鈉)、氯氣、硝酸替代雙氧水會引入新雜質.用氧氣替代雙氧水;
(3)調節溶液pH使Fe3+完全沉淀,使Ni2+不沉淀;
(4)過濾、蒸發都需要用玻璃儀器:玻璃棒,氫氧化鎳難溶于水,在結晶過程中,硫酸鎳可能水解,保持溶液較強酸性,抑制鎳離子水解;
(5)如果加入雙氧水不足,或反應時間較短,亞鐵離子不能完全轉化成鐵離子,產品中會混有硫酸亞鐵晶體,檢驗Fe2+試劑可以是氯水,KSCN溶液、酸性高錳酸鉀溶液等.
解答 解:(1)堿和鋁、氧化鋁均能反應,溶液中含有的含有金屬的離子是偏鋁酸根離子,故答案為:AlO2-;
(2)亞鐵離子具有還原性,雙氧水具有氧化性,加入雙氧水是為了氧化亞鐵離子成為鐵離子,離子反應方程式為:2Fe2++H2O2+2H+=2Fe3++2H2O,漂白液(主要成分次氯酸鈉)、氯氣、硝酸替代雙氧水會引入新雜質,故此替代試劑為氧氣,故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;A;
(3)由表格可知,氫氧化鐵的沉淀范圍為,2.7-3.2,鎳離子的沉淀范圍是7.1-9.2,調節pH在3.2-7.1的目的是除去鐵離子,但是不沉淀鎳離子,故答案為:除去Fe3+;
(4)操作a是過濾得到固體和濾液,c是蒸發濃縮得到晶體過濾得到NiSO4•7H2O,操作a、c中均需使用的儀器為玻璃棒,鎳離子水解呈酸性,溶液始終保持溶液呈酸性可以抑制其水解,故答案為:玻璃棒;保持溶液呈酸性;
(5)如果加入雙氧水不足,或反應時間較短,亞鐵離子不能完全被氧化成鐵離子,產品中混有綠礬;亞鐵離子可以被氧化為鐵離子,加入氧化劑即可驗證,正確的方法是:取少量樣品溶于蒸餾水,滴加酸性高錳酸鉀溶液,若溶液紫色褪去,則產品中含有亞鐵離子,
故答案為:產品中混有綠礬;取少量樣品溶于蒸餾水,滴加酸性高錳酸鉀溶液,若溶液紫色褪去,則產品中含有亞鐵離子.
點評 本題考查物質的制備,涉及離子反應方程式書寫,氧化還原反應,離子的驗證等,為高考常見題型和高頻考點,側重于學生的分析能力、實驗能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | ① | B. | ③ | C. | ②③ | D. | ①③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫原子的原子結構示意圖: | |
| B. | NH4Cl的電子式: | |
| C. | 原子核內有10個中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 乙烯的最簡式為CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 沸點(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 環己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 環己烷、乙醇和水共沸物 | 62.1 |



查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某化學探究小組擬用銅片制取Cu(NO3)2,并探究其化學性質.
某化學探究小組擬用銅片制取Cu(NO3)2,并探究其化學性質.| 實驗操作步驟 | 預期現象與結論 |
| 步驟1:觀察樣品 | 溶液呈藍綠色,不能(填“能”或“不能”確定產物中鐵元素的價態. |
步驟2:取少量溶液,滴加酸性KMn4溶液 | 若KMnO4溶液的紫紅色褪去或變淺,則說明產物中含+2價鐵元素,若KMnO4溶液不褪色或不變淺,則說明產物中不含+2價鐵元素 |
| 步驟3:另取少量溶液,滴加KSCN溶液 | 若溶液變為血紅色,說明產物中含+3價的鐵元素;若溶液顏色無明顯變化,則說明產物中不含+3價的鐵元素. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “春蠶到死絲方盡,蠟燭成灰淚始干”中的“絲”、“淚”分別是纖維素和油脂 | |
| B. | 乙醇、金屬鈉和乙酸分別屬于非電解質、非電解質和弱電解質 | |
| C. | Na2O2、Al2O3、C4H10分別屬于堿性氧化物、兩性氧化物和離子化合物 | |
| D. | 煤的氣化、石油的分餾分別是化學變化、物理變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃的強酸和稀的強堿溶液反應 | B. | 濃的弱酸和稀的強堿溶液反應 | ||
| C. | 等pH值的強酸和弱堿溶液反應 | D. | 生成一種強酸弱堿鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com