
分析 該溫度下NaCl溶液的質量分數=$\frac{S}{S+100}$×100%,該飽和溶液的物質的量濃度=$\frac{1000ρω}{M}$.
解答 解:某溫度下NaCl的溶解度為35g,則該溫度下NaCl溶液的質量分數=$\frac{S}{S+100}$×100%=$\frac{35g}{35g+100g}$×100%=25.9%,該飽和溶液的物質的量濃度=$\frac{1000ρω}{M}$=$\frac{1000×1.2×25.9%}{58.5}$mol/L=5.32mol/L,
故答案為:25.9%;5.32.
點評 本題考查物質的量濃度的有關計算,為高頻考點,明確各個物理量之間的關系是解本題關鍵,注意物質的量濃度公式中單位換算,為易錯點.


科目:高中化學 來源: 題型:解答題
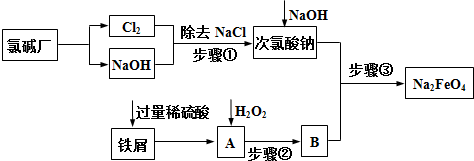
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同一弱電解質溶液,溫度不同時,導電能力相同 | |
| B. | 強電解質的水溶液導電能力一定比弱電解質的水溶液導電能力強 | |
| C. | 強電解質在水溶液中的電離過程是不可逆的 | |
| D. | 易溶于水的電解質一定是強電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在500℃、20 MPa條件下,在5 L密閉容器中進行合成氨的反應,使用催化劑后K增大 | |
| B. | 相同溫度下的酸、堿、鹽的稀溶液中水的離子積常數KW不同 | |
| C. | Ksp不僅與難溶電解質的性質和溫度有關,還與溶液中相關離子的濃度有關 | |
| D. | 室溫下K(HCN)<K(CH3COOH),等濃度的HCN和CH3COOH溶液pH較小的為CH3COOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
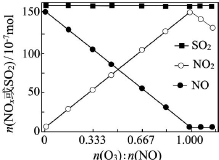 煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:
煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量.O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com