
 .C、D、E的簡單離子半徑由小到大的順序Al3+<Na+<O2-( 用離子符號表示).
.C、D、E的簡單離子半徑由小到大的順序Al3+<Na+<O2-( 用離子符號表示).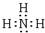 .檢驗該氣體的常用方法是用潤濕的紅色石蕊試紙接近該氣體,若試紙變藍,證明氨氣存在.
.檢驗該氣體的常用方法是用潤濕的紅色石蕊試紙接近該氣體,若試紙變藍,證明氨氣存在.分析 短周期元素A、B、C、D、E的原子序數依次增大,A元素陽離子的原子核外沒有電子,則A為氫元素;B是空氣中含量最多的元素,B為氮元素;C元素原子最外層電子數是其電子層數的三倍,C只能處于第二周期,最外層電子數為6,故C為氧元素,且C與D可形成兩種常見的離子化合物,故D為Na元素;工業上常用電解C與E的化合物來制備E單質,E為Al元素,據此進行解答.
解答 解:短周期元素A、B、C、D、E的原子序數依次增大,A元素陽離子的原子核外沒有電子,則A為氫元素;B是空氣中含量最多的元素,B為氮元素;C元素原子最外層電子數是其電子層數的三倍,C只能處于第二周期,最外層電子數為6,故C為氧元素,且C與D可形成兩種常見的離子化合物,故D為Na元素;工業上常用電解C與E的化合物來制備E單質,E為Al元素,
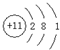
(1)Na原子核外電子數為11,有3個電子層,各層電子數為2、8、1,原子結構示意圖為: ;
;
電子層結構相同核電荷數越大離子半徑越小,故C、D、E簡單離子半徑Al3+<Na+<O2-,
故答案為: ;Al3+<Na+<O2-;
;Al3+<Na+<O2-;
(2)E為Al元素,原子序數為13,處于周期表中第三周期ⅢA族,
故答案為:第三周期ⅢA族;
(3)工業上常用A和B的單質合成一種常見氣體為NH3,分子中氮原子與氫原子之間形成1對共用電子對,該氣體的電子式 為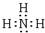 ,檢驗氨氣的常用方法是:用潤濕的紅色石蕊試紙接近該氣體,若試紙變藍,證明氨氣存在,
,檢驗氨氣的常用方法是:用潤濕的紅色石蕊試紙接近該氣體,若試紙變藍,證明氨氣存在,
故答案為: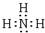 ;用潤濕的紅色石蕊試紙接近該氣體,若試紙變藍,證明氨氣存在;
;用潤濕的紅色石蕊試紙接近該氣體,若試紙變藍,證明氨氣存在;
(4)Na2O2與H2O反應生成NaOH與O2,化學方程式是2Na2O2+2H2O=4NaOH+O2↑.Na2O2與CuSO4溶液反應,首先與H2O反應生成NaOH與O2,然后NaOH與CuSO4溶液反應生成Cu(OH)2,故現象是:產生藍色沉淀并有氣泡放出,
故答案為:2Na2O2+2H2O=4NaOH+O2↑;產生藍色沉淀并有氣泡放出;
(5)由H、N、O按原子個數比4:2:3形成的化合物為NH4NO3,其電離方程式為:NH4NO3=NH4++NO3-,
故答案為:NH4NO3=NH4++NO3-.
點評 本題考查結構性質位置關系,題目難度中等,推斷元素是解題關鍵,涉及核外電子排布、離子半徑比較、元素化合物性質、常用化學用語等知識,注意掌握原子結構與元素周期律、元素周期表的關系.


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸鈉是發酵粉的主要成分,而碳酸氫鈉是治療胃穿孔的一種藥劑 | |
| B. | 硅酸鈉的水溶液俗稱水玻璃,可用作木材防火劑 | |
| C. | 大量生產一次性超薄塑料袋,方便人們日常生活 | |
| D. | 為補充人體所需的營養成分,人人都應食用添加營養強化劑的食品 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體摩爾體積就是22.4 L•mol-1 | |
| B. | 1 mol H2所占的體積約為22.4 L | |
| C. | 在標準狀況下,1 mol H2O(g)的體積是22.4 L | |
| D. | 在標準狀況下,1 mol NH3和CO混合氣體所占的體積約為22.4 L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.76 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| C. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1 451.52 kJ•mol-1 | |
| D. | 2H2+O2═2H2O△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
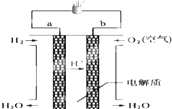 人們應用原電池原理制作了多種電池,以滿足不同的需要.以下每小題中的電池廣泛使用于日常生活、生產和科學技術等方面,請根據題中提供的信息,填寫空格.
人們應用原電池原理制作了多種電池,以滿足不同的需要.以下每小題中的電池廣泛使用于日常生活、生產和科學技術等方面,請根據題中提供的信息,填寫空格.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只要有一種反應物的鍵能大于一種生成物的鍵能,這個反應就是放熱反應 | |
| B. | 只要有一種反應物的鍵能大于一種生成物的鍵能,這個反應就是吸熱反應 | |
| C. | 反應物的鍵能之和比生成物的鍵能之和大得越多,反應放出的能量就越多 | |
| D. | 反應物的鍵能之和比生成物的鍵能之和大得越多,反應吸收的能量就越多 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com