
| A. | 鈉鉀合金可用于中子反應堆作熱交換劑 | |
| B. | 氯氣本身有毒,因此不能用于藥物合成 | |
| C. | 不用氧化鎂電解熔融制鎂的原因是氧化鎂不導電 | |
| D. | 工業高爐煉鐵過程中,加石灰石主要是為了制備還原劑 |
分析 A.鈉和鉀的合金具有良好的導熱性;
B.氯氣是有毒氣體,但可以合成藥物所需的化合物;
C.MgO熔點很高,能耗太大,不經濟;
D.根據石灰石中的碳酸鈣在高溫條件下分解能生成氧化鈣和二氧化碳,氧化鈣能和二氧化硅反應生成硅酸鈣,從而除去鐵礦石中的二氧化硅;
解答 解:A.鈉和鉀的合金具有良好的導熱性,可用于中子反應堆作熱交換劑,故A正確;
B.氯氣是有毒氣體,但可以合成藥物所需的化合物,能用于藥物的合成,故B錯誤;
C.因為MgO熔點很高,能耗太大,不經濟,所以利用氯化鎂冶煉金屬鎂而不利用氧化鎂,故C錯誤;
D.石灰石中的碳酸鈣在高溫條件下分解能生成氧化鈣和二氧化碳,氧化鈣能和二氧化硅反應生成硅酸鈣,從而除去鐵礦石中的二氧化硅,即煉鐵高爐中加入石灰石的目的是除去脈石(二氧化硅),故D錯誤;
故選A.
點評 本題考查了合金、金屬的性質和冶煉方法,工業生產過程中試劑的作用,注意物質性質的應用,題目難度不大.


 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案科目:高中化學 來源: 題型:解答題
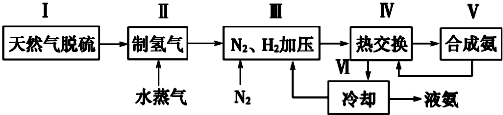
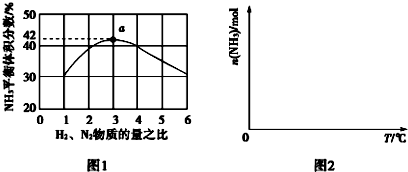
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
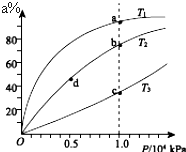 現有反應:mA+nB?ρC,在某溫度下達到平衡狀態.
現有反應:mA+nB?ρC,在某溫度下達到平衡狀態.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 不同時間各物質的物質的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
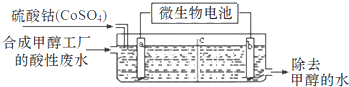
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應N2(g)+3H2(g)═2NH3(g),其他條件不變時充入N2,正反應速率增大,逆反應速率減小 | |
| B. | 常溫下,2NO(g)+O2(g)═2NO2(g)能夠自發進行,則該反應的△H<0 | |
| C. | 向0.1mol/L CH3COOH溶液中加入少量的冰醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})}$的值變小 | |
| D. | 電解法精煉銅時,以粗銅作陰極,純銅作陽極 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com