
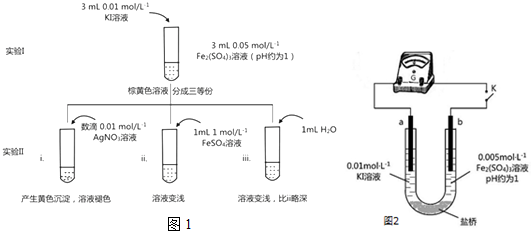
分析 (1)待實驗I溶液顏色不再改變時,再進行實驗II,目的是使實驗I的反應達到化學平衡狀態;
(2)根據實驗iii和實驗ii的對比可以看出是為了排除有ii中水造成溶液中離子濃度改變的影響;
(3)i.加入AgNO3,Ag+與I-生成AgI黃色沉淀,I-濃度降低,2Fe3++2I-?2Fe2++I2平衡逆向移動;
ii.加入FeSO4,Fe2+濃度增大,平衡逆移;
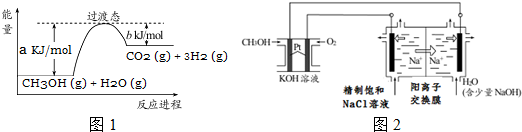
①K閉合時,指針向右偏轉,可知b極Fe3+得到電子,作正極;
②當指針歸零(反應達到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液,若生成黃色沉淀,可知I-濃度降低,2Fe3++2I-?2Fe2++I2平衡逆向移動;
(5)①Fe2+濃度增大,還原性增強;
②與(4)實驗對比,不同的操作是當指針歸零(反應達到平衡)后,向U型管右管中滴加0.01mol/L FeSO4溶液;
(6)將(3)和(4)、(5)作對比,可知氧化性、還原性與濃度有關.
解答 解:(1)待實驗I溶液顏色不再改變時,再進行實驗II,目的是使實驗I的反應達到化學平衡狀態,否則干擾平衡移動的判斷,
故答案為:化學平衡狀態;
(2)由實驗iii和實驗ii的對比可知,對比實驗的目的是為了排除有ii中水造成溶液中離子濃度改變的影響,
故答案為:溶液稀釋對顏色的變化;
(3)i.加入AgNO3,Ag+與I-生成AgI黃色沉淀,I-濃度降低,2Fe3++2I-?2Fe2++I2平衡逆向移動,可知Fe2+向Fe3+轉化,
故答案為:Ag+與I-生成AgI黃色沉淀,I-濃度降低,2Fe3++2I-?2Fe2++I2平衡逆向移動;
ii.加入FeSO4,Fe2+濃度增大,平衡逆移;
①K閉合時,指針向右偏轉,右側為正極,可知b極Fe3+得到電子,則b作正極,
故答案為:正;
②當指針歸零(反應達到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液,若生成黃色沉淀,I-濃度降低,2Fe3++2I-?2Fe2++I2平衡逆向移動,指針向左偏轉,也可證明推測Fe2+向Fe3+轉化,
故答案為:左管出現黃色沉淀,指針向左偏轉;
(5)①轉化的原因為Fe2+濃度增大,還原性增強,使Fe2+還原性強于I-,
故答案為:Fe2+濃度增大,還原性增強,使Fe2+還原性強于I-;
②與(4)實驗對比,不同的操作是當指針歸零(反應達到平衡)后,向U型管右管中滴加0.01mol/L FeSO4溶液,Fe2+向Fe3+轉化,
故答案為:向U型管右管中滴加0.01mol/L FeSO4溶液;
(6)將(3)和(4)、(5)作對比,得出的結論是該反應為可逆的氧化還原反應,在平衡時,通過改變物質的濃度,可以改變物質的氧化、還原能力,并影響平衡移動,
故答案為:該反應為可逆的氧化還原反應,在平衡時,通過改變物質的濃度,可以改變物質的氧化、還原能力,并影響平衡移動.
點評 本題為2015年北京高考真題,側重原電池、氧化還原反應及平衡移動的綜合考查,把握平衡移動的影響因素及物質的性質為解答的關鍵,對分析與實驗能力要求較高,題目難度較大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
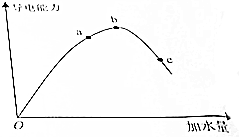 在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力如圖所示,請回答:
在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力如圖所示,請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水分子中共價鍵比氯化鈉中離子鍵弱 | |
| B. | 水的相對分子質量比氯化鈉的小 | |
| C. | 水分子間有范德華力,氯化鈉分子間的作用力較強 | |
| D. | 水分子間是以范德華力相結合,相互作用較弱;氯化鈉晶體中,Na+和Cl-以離子鍵相結合,作用力較強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀硝酸中加入過量鐵粉:Fe+4H++NO${\;}_{3}^{-}$═Fe3++NO↑+2H2O | |
| B. | 向NH4HSO4溶液中逐滴滴入Ba(OH)2溶液至恰好沉淀完全2OH-+Ba2++2H++SO${\;}_{4}^{2-}$═2H2O+BaSO4↓ | |
| C. | 向亞硫酸鋇固體中加入稀硝酸:3BaSO3+2H++2NO${\;}_{3}^{-}$═3BaSO4↓+2NO↑+H2O | |
| D. | 向Ca(ClO)2溶液中通入足量CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、SO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、K+ | B. | Na+、Cu2+、Br-、Ba2+ | ||
| C. | K+、MnO${\;}_{4}^{-}$、NO${\;}_{3}^{-}$、Na+ | D. | K+、Ca2+、SO${\;}_{3}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
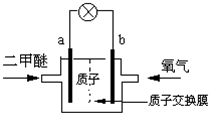 新能源開發中的燃料電池是低碳研究的重要領域.
新能源開發中的燃料電池是低碳研究的重要領域.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com