
| 物質 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
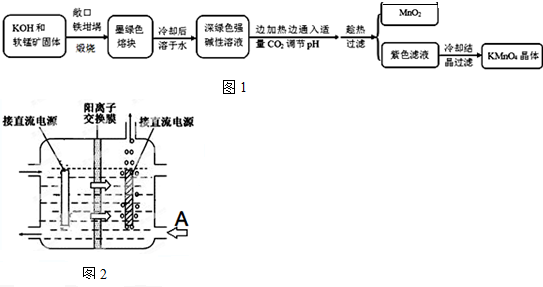
分析 以軟錳礦(主要成分是MnO2)為原料制備高錳酸鉀晶體,軟錳礦固體和KOH固體混合在鐵坩堝中煅燒,得到墨綠色熔塊,為錳酸鉀,冷卻后溶于水其水溶液呈深綠色,這是錳酸根(MnO42-)在堿溶液中的特征顏色,邊加熱邊通入適量二氧化碳氣體,調節溶液PH趁熱過濾得到二氧化錳固體和高錳酸鉀溶液,冷卻結晶得到高錳酸鉀晶體;
(1)瓷坩堝中的二氧化硅和強堿反應,坩堝被腐蝕;
(2)工藝流程可知,CO2使MnO42-發生歧化反應,生成MnO4-和MnO2,根據元素守恒可知,會生成K2CO3,若通入CO2太多,會生KHCO3,濾液中含有KHCO3、KMnO4;氧化還原反應中氧化劑是元素化合價降低的物質,還原劑是元素化合價升高的物質,結合化學方程式定量關系和電子守恒計算;
(3)分析鹽酸具有還原性容易被高錳酸鉀氧化,使產品變質,硫酸反應生成的硫酸鉀溶解度小,會隨高錳酸鉀晶體析出;
(4)惰性電極電解錳酸鉀溶液制取高錳酸鉀,錳酸根離子在陽極失電子生成高錳酸根離子,溶液中氫離子在陰極得到電子生成氫氣,溶液中氫氧根離子濃度增大生成堿,陽離子交換膜分隔兩極區進行電解錳酸鉀溶液制取高錳酸鉀,陽離子移向方向可知左邊電極為陽極,右邊冒氣泡的電極為陰極,為維持電解質溶液電荷守恒,A處最好加入氫氧化鉀溶液,使用陽離子交換膜可以提高Mn元素利用率是因為陽離子交換膜防止錳酸根進入陰極區.
解答 解:(1)瓷坩堝中的二氧化硅和強堿反應,坩堝被腐蝕,加熱軟錳礦和KOH固體時,不采用瓷坩堝而選用鐵坩堝,
故答案為:高溫下強堿會和瓷坩堝中的二氧化硅反應腐蝕坩堝;
(2)工藝流程可知,CO2使MnO42-發生歧化反應,生成MnO4-和MnO2,根據元素守恒可知,會生成K2CO3,若通入CO2太多,會生KHCO3,濾液中含有KHCO3、KMnO4,在加熱濃縮時,會有KHCO3晶體和KMnO4晶體一起析出,實驗中通入適量CO2時體系中可能發生反應離子方程式為:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O,其中氧化還原反應中氧化劑和還原劑都是高錳酸鉀,所以氧化劑和還原劑的質量比即為反應的物質的量之比為1:2;
故答案為:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;1:2;
(3)因為鹽酸具有還原性,易被高錳酸鉀氧化,醋酸鉀的溶解度比硫酸鉀大的多,蒸發濃縮時基本上都會留在母液中,硫酸加入生成的硫酸鉀溶解度小,會隨KMnO4一起結晶析出得到的高錳酸鉀中含有雜質;
故答案為:A;
(4)惰性電極電解錳酸鉀溶液制取高錳酸鉀,錳酸根離子在陽極失電子生成高錳酸根離子,溶液中氫離子在陰極得到電子生成氫氣,溶液中氫氧根離子濃度增大生成堿,電解反應的化學方程式為:2K2MnO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2KMnO4+H2↑+2KOH,陽離子交換膜分隔兩極區進行電解錳酸鉀溶液制取高錳酸鉀,陽離子移向方向可知左邊電極為陽極,右邊冒氣泡的電極為陰極,為維持電解質溶液電荷守恒,A處最好加入氫氧化鉀溶液,使用陽離子交換膜可以提高Mn元素利用率是因為陽離子交換膜防止錳酸根進入陰極區被還原;
故答案為:2K2MnO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2KMnO4+H2↑+2KOH;KOH溶液;陽離子交換膜防止錳酸根進入陰極區被還原.
點評 本題考查常見氧化劑與還原劑、氧化還原反應、化學計算和對工藝流程的理解、閱讀題目獲取信息的能力等,難度中等,需要學生具有扎實的基礎知識與靈活運用知識解決問題的能力.


科目:高中化學 來源: 題型:選擇題

| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 3CO+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$3CO2+2Fe | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高溫\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
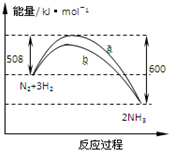
| A. | 1 mo N2與3 mo H2反應可以放出92 kJ的熱量 | |
| B. | b曲線是加入催化劑時的能量變化曲線 | |
| C. | 加入催化劑,該反應的焓變減小 | |
| D. | 正反應的活化能等于逆反應的活化能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
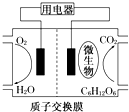
| A. | 該電池不能夠在高溫下工作 | |
| B. | 電池的負極反應:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| C. | 放電過程中,H+會從負極區向正極區遷移 | |
| D. | 在電池反應中,每消耗1mol氧氣,理論上能生成標準狀況下CO2氣體$\frac{22.4}{6}$ L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向地勢低的地方撤離 | |
| B. | 用濕毛巾或蘸有燒堿水的毛巾捂住口鼻撤離 | |
| C. | 觀察風向,順風撤離 | |
| D. | 用濕毛巾或蘸有稀純堿水的毛巾捂住口鼻撤離 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molCO2的質量為44g/mol | |
| B. | CO2的摩爾質量為44g | |
| C. | CO2的摩爾質量等于CO2的相對分子質量 | |
| D. | NA個CO2的質量與CO2的相對分子質量在數值上相同(NA為阿伏加德羅常數) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com