
【題目】用惰性電極電解一定量的硫酸銅溶液,實驗裝置如圖甲。電解過程中的實驗數據如圖乙,橫坐標表示電解過程中轉移電子的物質的量,縱坐標表示電解過程中產生氣體的總體積(標準狀況)。則下列說法不正確的是
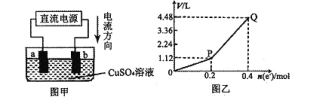
A.電解過程中,a電極表面先有紅色物質析出,后有氣泡產生
B.b電極上發生的反應方程式為:4OH-一4e-=2H2O+O2↑
C.曲線O一P段表示H2的體積變化
D.Q點時收集到的混合氣體中H2和O2體積比為1:1
【答案】C
【解析】
電解硫酸銅溶液時,電流由電池的正極流向負極,則b為陽極,a為陰極,電極反應式,陽極:2H2O-4e-=4H++ O2↑;陰極:Cu2++ 2e-=Cu、2H++ 2e-=H2↑;
A. 電解過程中,a電極為陰極,溶液中的Cu2+得電子生成Cu,則表面先有紅色物質析出,后有H+得電子生成氫氣,有氣泡產生,A正確;
B. b電極為陽極,溶液中的水失電子生成氧氣,發生的反應方程式為:4OH--4e-=2H2O+O2↑,B正確;
C. 曲線O-P段,陽極生成氧氣,陰極生Cu,表示O2的體積變化,C錯誤;
D. Q點時收集到的混合氣體中,H2和O2標況下的體積分別為2.24L,體積比為1:1,D正確;
答案為C。


科目:高中化學 來源: 題型:
【題目】試根據氧化還原反應:2FeCl3+Cu=2FeCl2+CuCl2設計原電池,并畫出裝置圖________________,指出電解質溶液是________________,負極是________________,電極反應式為__________________,正極是___________,電極反應式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某些共價鍵的鍵能數據如表(單位:kJmol-1):
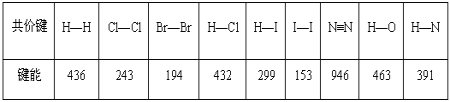
(1)把1mol Cl2分解為氣態原子時,需要___(填“吸收”或“放出”)243kJ能量。
(2)由表中所列化學鍵形成的單質分子中,最穩定的是___;形成的化合物分子中最不穩定的是___。
(3)發射火箭時用氣態肼(N2H4)作燃料,二氧化氮作氧化劑,兩者反應生成氮氣和氣態水。已知32gN2H4(g)完全發生上述反應放出568kJ的熱量,熱化學方程式是:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】84消毒液、酒精、過氧乙酸等消毒劑在抗擊新型冠狀病毒肺炎疫情中起到重要作用。回答下列問題:
Ⅰ.84消毒液是北京第一傳染病醫院(現北京地壇醫院)于1984年研制的一種消毒液,主要成分為受熱易分解的次氯酸鈉(NaClO)。某實驗小組用如圖裝置制備84消毒液。
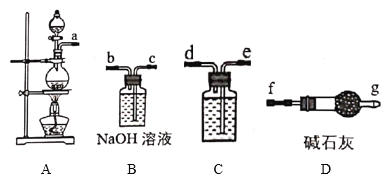
(1)A中發生反應的離子方程式為___。
(2)C中盛裝試劑為__,儀器的連接順序為a→__。
(3)制備84消毒液時,若Cl2與NaOH溶液反應溫度過高,NaClO的產率將__(填“增大”“減小”或“不變”)。
Ⅱ.過氧乙酸(CH3COOOH)是無色液體,易溶于水,有強烈刺激性氣味,有腐蝕性,對人的眼睛、皮膚、黏膜、上呼吸道等有強烈刺激作用,易分解,易爆炸。
(4)貯存和運輸CH3COOOH時要注意的事項是__。
(5)消毒過程中需將200mL20%的過氧乙酸(密度為1.02g·cm-3)稀釋為0.5%的過氧乙酸,則需加入水的體積為__![]() 。
。
(6)CH3COOOH可用H2O2和CH3COOH制備,其化學方程式為___。
(7)制備CH3COOOH過程中總會殘留少量H2O2,因此CH3COOOH在使用過程中需要準確標定原液的濃度。取CH3COOOH樣品![]() ,標定步驟如下:
,標定步驟如下:
a.用KMnO4標準溶液滴定H2O2;
b.當達到終點時加入足量KI溶液,發生反應:2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
c.用1.500mol·L-1Na2S2O3標準溶液滴定生成的I2,發生反應:I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液20.00mL。
測得樣品中CH3COOOH的質量分數為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A+B→C △H <0,分兩步進行 ① A+B→X △H>0 ② X→C △H<0 。下列示意圖中,能正確表示總反應過程中能量變化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的鎂鋁合金投入100 mL一定濃度的鹽酸中,合金完全溶解。向所得溶液中滴加濃度為5 mol·L-1的氫氧化鈉溶液,生成的沉淀跟加入的氫氧化鈉溶液的體積關系如圖(橫坐標體積單位是mL,縱坐標質量單位是g)。
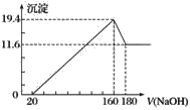
(1)合金中鎂的質量是__________。
(2)所用鹽酸的物質的量濃度是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是水煤氣(成分為CO、H2)空氣燃料電池的工作原理示意圖,a、b均為惰性電極。下列敘述中正確的是

A. A處通入空氣,B處通入水煤氣
B. a電極的反應式包括:CO+4OH--2e-= CO32-+2H2O
C. a電極發生還原反應,b電極發生氧化反應
D. 如用這種電池電鍍銅,當鍍件增重6.4g,則消耗標準狀況下的水煤氣4.48 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、鈉硫電池作為一種新型儲能電池,其應用逐漸得到重視和發展。鈉硫電池以熔融金屬鈉、熔融硫和多硫化鈉(Na2Sx)分別作為兩個電極的反應物,固體Al2O3陶瓷(可傳導Na+)為電解質,其反應原理如圖所示:
物質 | Na | S | Al2O3 |
熔點/℃ | 97.8 | 115 | 2050 |
沸點/℃ | 892 | 444.6 | 2980 |
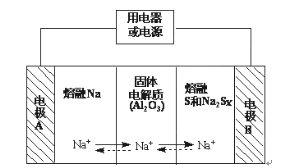
(1)請判斷該電池工作的適宜溫度應控制在____范圍內(填字母序號)。
A.常溫 B.60℃~ 100℃ C.200℃~350℃ D.2000℃~3000℃
(2)放電時,電極A為___極。
(3)放電時,內電路中Na+的移動方向為___(填“從A到B”或“從B到A”)。
(4)充電時,總反應為Na2Sx=2Na+xS(3<x<5),則陽極的電極反應式為___。
Ⅱ、用NaOH溶液吸收煙氣中的SO2,將所得的Na2SO3溶液進行電解,可循環再生NaOH,同時得到H2SO4,其原理如圖所示。(電極材料為石墨)
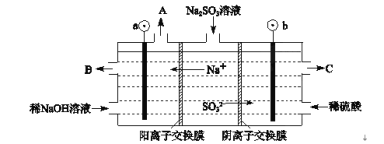
(1)圖中a極要連接電源的(填“正”或“負”)___極,C口流出的物質是___。
(2)SO32-放電的電極反應式為____。
(3)電解過程中陰極區堿性明顯增強,請結合電極方程式解釋原因___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁(AlN,Al和N的相對原子質量分別為27和14)廣泛用于電子、陶瓷等工業領域。在一定條件下,AlN可通過反應Al2O3+N2+3C![]() 2AlN+3CO合成。下列敘述正確的是( )
2AlN+3CO合成。下列敘述正確的是( )
A.上述反應中,N2是還原劑,Al2O3是氧化劑
B.上述反應中,每生成1mol AlN需轉移3mol電子
C.AlN中氮元素的化合價為+3
D.AlN的摩爾質量為41g
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com