
| 組號 | 反應溫度(℃) | 參加反應的物質 | ||||
| Na2S2O3 | H2SO4 | H2O的體積(mL) | ||||
| 體積(mL) | 濃度(mol•L-1) | 體積(mL) | 濃度(mol•L-1) | |||
| A | 10 | 5.0 | 0.10 | 10.0 | 0.10 | 5.0 |
| B | 10 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| C | 30 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| D | 30 | 5.0 | 0.20 | 5.0 | 0.10 | 10.0 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化學 來源: 題型:解答題
| 實驗操作 | 實驗現象 | 結論 |
| 在“褐變”后的蘋果上滴上2~3滴 KSCN溶液. | 無紅色出現 | 說法A不正確 |
| 序號 | 實驗步驟 | 現 象 | 結 論 |
| ① | 在一塊上滴加2~3滴FeCl3溶液 | 表面變為綠色 | 對苯二酚 |
| ② | 再取兩塊,一塊放置于空氣中,另一塊迅速浸入經過去氧的蒸餾水中. | 前者表面逐漸褐變,后者相當長一段時間內,無明顯變化. | 蘋果褐變與氧氣有關 |
| ③ | 另兩塊分別立刻放入沸水和0.1mol•L-1鹽酸中浸泡2min后取出,置于空氣中. | 相當長一段時間內,兩塊均無明顯變化. | 蘋果褐變與酚氧化酶的活性有關 |
| ④ | 最后兩塊分別立刻放入濃度均為0.1mol•L-1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空氣中. | 前者經過一段時間表面逐漸褐變,后者相當長一段時間內,無明顯變化. | 亞硫酸鈉溶液能阻止蘋果褐變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
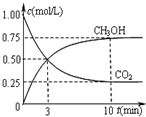 工業上可以以煤和水為原料通過一系列轉化變為清潔能源氫氣或工業原料甲醇.
工業上可以以煤和水為原料通過一系列轉化變為清潔能源氫氣或工業原料甲醇.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
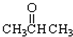 ③CH3CH2Br ④
③CH3CH2Br ④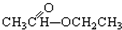 ⑤
⑤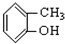 ⑥
⑥ ⑦
⑦ ⑧
⑧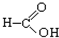 ⑨
⑨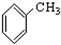 ⑩
⑩
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
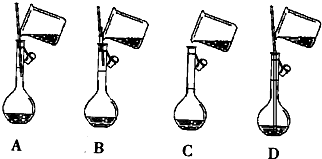
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | W、M的離子半徑及最高價氧化物對應水化物的堿性皆為M<W | |
| B. | YZ2為直線型的共價化合物,W2Z2既含有離子鍵又含有共價鍵 | |
| C. | Y與X形成的化合物的熔沸點一定低于Z與X形成的化合物的熔沸點 | |
| D. | Z與M形成的化合物可作為耐高溫材料,W、M、X以1:1:4組成的化合物是應用前景很廣泛的儲氫材料,具有很強的還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
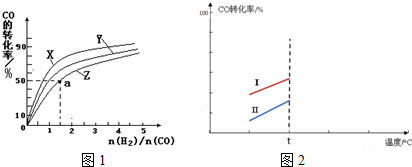
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、CO32-、NO3-、Cl- | B. | Na+,NH4+、Cl-,SO42- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Ba2+、Br-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com