
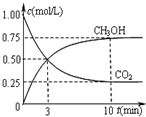
 工業上可以以煤和水為原料通過一系列轉化變為清潔能源氫氣或工業原料甲醇.
工業上可以以煤和水為原料通過一系列轉化變為清潔能源氫氣或工業原料甲醇.分析 (1)反應熱與物質的聚集狀態有關,聚集狀態不同,反應熱不同;
(2)①可逆反應中增大一種反應物濃度可以提高另一種反應物轉化率;
依據CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0為氣體體積減小的、放熱反應特點結合影響化學平衡移動的因素解答;
②.ⅰ.計算平衡時氫氣、水的濃度,再根據K=$\frac{c(CH{\;}_{3}OH)×c({H}_{2}O)}{c(CO{\;}_{2})×{c}^{3}(H{\;}_{2})}$計算平衡常數;
保持溫度不變,向該密閉容器中再充入1mol CO2(g)和1mol H2O(g),相當于增大壓強,增壓平衡向氣體系數小的方向移動;
ⅱ.平衡時滿足V正=V逆,v正=k正•c(A)a•c(B)b;V逆=k逆•c(C)c•c(D)d,則k逆:k正=$\frac{c(CH{\;}_{3}OH)×c({H}_{2}O)}{c(CO{\;}_{2})×{c}^{3}(H{\;}_{2})}$=K;
計算3mim時各物質濃度,據此計算正逆反應瞬時速率之比.
解答 解:(1)反應熱與物質的聚集狀態有關,聚集狀態不同,反應熱不同,上述反應與氫氣燃燒熱的反應中水的狀態不同,所以不能求出上述反應的焓變;
故答案為:不能;因為上述反應與氫氣燃燒熱的反應中水的狀態不同;
(2)①C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0生成二氧化碳和氫氣的物質的量之比為1:2,而
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,二氧化碳和氫氣物質的量之比為1:3,相對與增大二氧化碳濃度,所以氫氣的轉化率大于二氧化碳轉化率;
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0為氣體體積減小的、放熱反應,要想提高甲醇的產率可以采取的措施是降低溫度、增大壓強使平衡向正向移動;
故答案為:后者大;降低溫度、增大壓強;
②ⅰ平衡時甲醇為0.75mol/L、二氧化碳為0.25mol/L,則:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始濃度(mol/L):1 3 0 0
變化濃度(mol/L):0.75 2.25 0.75 0.75
平衡濃度(mol/L):0.50 0.75 0.75 0.75
則平衡常數K=$\frac{c(CH{\;}_{3}OH)×c({H}_{2}O)}{c(CO{\;}_{2})×{c}^{3}(H{\;}_{2})}$=$\frac{0.75×0.75}{0.25×0.75{\;}^{3}}$=$\frac{16}{3}$=5.33;
保持溫度不變,向該密閉容器中再充入1mol CO2(g)和1mol H2O(g),相當于增大壓強,增壓平衡向氣體系數小的方向移動,即向正方向移動;
故答案為:5.33;正向;
ⅱ平衡時滿足V正=V逆,v正=k正•c(A)a•c(B)b;V逆=k逆•c(C)c•c(D)d,
則k逆:k正=$\frac{c(CH{\;}_{3}OH)×c({H}_{2}O)}{c(CO{\;}_{2})×{c}^{3}(H{\;}_{2})}$=K=3:16;
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始濃度(mol/L):1 3 0 0
變化濃度(mol/L):0.50 1.50 0.50 0.50
3min濃度(mol/L):0.50 1.50 0.50 0.50
v正=k正•c(A)a•c(B)b;
V逆=k逆•c(C)c•c(D)d;
V正:V逆=$\frac{{\;}_{k正}•c(A){\;}^{a}•c(B){\;}^{b}}{k{\;}_{逆}•c(C){\;}^{c}•c(D){\;}^p9vv5xb5}$=$\frac{{K}_{正}}{{K}_{逆}}$•$\frac{0.5×1.5{\;}^{3}}{0.5×0.5}$=36;
故答案為:3:16; 36.
點評 本題為綜合題,涉及反應熱的計算、化學平衡平衡移動影響因素、化學平衡常數計算,題目難度較大,解題關鍵需掌握化學平衡理論,注意三段式的應用.


 每課必練系列答案
每課必練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1 mol熔融的KHSO4中含有2 NA個陽離子 | |
| B. | 1 L 0.1 mol/LCH3COONa溶液中,陰離子總數小于0.1 NA | |
| C. | 標準狀況下,6.72 L NO2與水充分反應轉移的電子數目為0.1NA | |
| D. | 與常溫常壓下17g H2O2所含非極性鍵數目相同的N2H4的分子總數為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X氫化物溶于水后,在常溫下,該溶液的pH<7 | |
| B. | Y的最高價氧化物的水化物具有兩性 | |
| C. | Z離子在水溶液中水解導致其溶液顯堿性 | |
| D. | 簡單離子的半徑:Y>Z>X |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷與乙烷體積比為1:4 | B. | 乙烯與丁烷體積比為4:1 | ||
| C. | 丙炔與乙炔物質的量比為4:1 | D. | 乙烯與丁烯物質的量比為1:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 組號 | 反應溫度(℃) | 參加反應的物質 | ||||
| Na2S2O3 | H2SO4 | H2O的體積(mL) | ||||
| 體積(mL) | 濃度(mol•L-1) | 體積(mL) | 濃度(mol•L-1) | |||
| A | 10 | 5.0 | 0.10 | 10.0 | 0.10 | 5.0 |
| B | 10 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| C | 30 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| D | 30 | 5.0 | 0.20 | 5.0 | 0.10 | 10.0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a=b=100 | B. | a=b=1000 | C. | a<b | D. | a>b |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com