
| A. | 磁性氧化鐵溶于稀硝酸:Fe3O4+8H++NO3-═3Fe3++NO↑+4H2O | |
| B. | Ca(HCO3)2溶液中加入過量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | NH4HCO3溶于過量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 氫氧化鋇溶液與稀硫酸反應:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
分析 A.硝酸具有氧化性,反應生成鐵離子和水;
B.氫氧化鈉過量,反應生成碳酸鈣、碳酸鈉和水;
C.氫氧化鈉過量,銨根離子、碳酸氫根離子都反應;
D.離子個數配比不符合物質結構組成.
解答 解:A.將磁性氧化鐵溶于足量稀硝酸中的離子反應為3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故A錯誤;
B.Ca(HCO3)2溶液中加入過量NaOH溶液,離子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故B正確;
C.NH4HCO3溶于過量的NaOH溶液中,離子方程式:NH4++HCO3-+2OH-═CO32-+H2O+NH3•H2O,故C錯誤;
D.氫氧化鋇溶液與稀硫酸反應,離子方程式:Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O,故D錯誤;
故選:B.
點評 本題考查離子反應方程式的書寫,明確發生的化學反應是解答本題的關鍵,注意氧化還原反應中電子守恒,題目難度不大.


 新課標階梯閱讀訓練系列答案
新課標階梯閱讀訓練系列答案 口算心算速算應用題系列答案
口算心算速算應用題系列答案科目:高中化學 來源:2016-2017學年江蘇省徐州市高一上第一次月考化學卷(解析版) 題型:選擇題
下列反應屬于加成反應的是
A.CH4+Cl2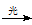 CH3Cl+HCl
CH3Cl+HCl
B.CH2===CH2+HBr→CH3CH2Br
C.CH3COOH+CH3CH2OH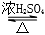 CH3COOCH2CH33+H2O
CH3COOCH2CH33+H2O
D.2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈰(Ce)元素在自然界中主要以化合態形式存在 | |
| B. | 鈰溶于氫碘酸的化學方程式可表示為:Ce+4HI═CeI4+2H2↑ | |
| C. | 用Ce(SO4)2溶液滴定硫酸亞鐵溶液,其離子方程式為:Ce4++Fe2+═Ce3++Fe3+ | |
| D. | 四種穩定的核素58136Ce、58138Ce、58140Ce、58142Ce,它們互稱為同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl-濃度為0.2 mol/L | |
| B. | 取出10 mL溶液中Ba2+濃度為0.2 mol/L | |
| C. | 溶液中Cl-總數為0.2NA | |
| D. | 取出50 mL溶液中Ba2+和Cl-總數為0.03NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.5 mol CO+2.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2 | |
| B. | 1.0 mol CO+2.0 mol H2O(g)+0.5 mol He | |
| C. | 1.0 mol CO+1.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2 | |
| D. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 輪船水線以下的船殼上裝上一定數量的鋅塊 | |
| B. | 銀質獎章久置后表面變暗 | |
| C. | 黃銅(銅鋅合金)制作的銅鑼不易產生銅綠 | |
| D. | 純鋅與稀H2SO4反應滴入少量的CuSO4溶液后反應速率加快 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省高二上第一次月考化學試卷(解析版) 題型:選擇題
下列是4位同學在學習“化學反應速率和化學平衡”一章后,聯系工業生產實際所發表的觀點,你認為不正確的是( )
A. 化學反應速率理論是研究怎樣在一定時間內快出產品
B. 化學平衡理論是研究怎樣使用有限原料多出產品
C. 化學平衡理論是研究怎樣使原料盡可能多地轉化為產品
D. 化學反應速率理論是研究怎樣提高原料轉化率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com