
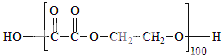 無機非金屬材料、金屬材料和有機高分子材料并稱為三大材料,是發展高新技術的基石,在未來科技發展中發揮著重要的作用.
無機非金屬材料、金屬材料和有機高分子材料并稱為三大材料,是發展高新技術的基石,在未來科技發展中發揮著重要的作用.| 18K金成分 | Au | Ag | Cu |
| 含量(質量分數) | 75.00% | 11.44% | 13.56% |
分析 (1)①高溫條件下,Fe和H2O反應生成Fe3O4和H2,固體增加的質量為氧元素質量,根據固體增加的質量與氫氣的關系式計算;
②Fe和FeCl3反應生成FeCl2,根據鐵和FeCl3之間的關系式計算FeCl3的物質的量;
(2)根據元素守恒、原子守恒確定化學式;
(3)①混合氣體的物質的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,根據原子守恒、轉移電子守恒計算氣體的質量,再根據M=$\frac{m}{n}$計算混合氣體摩爾質量;
②根據轉移電子確定合金中的其它元素,再根據轉移電子相等計算銀的質量,從而確定銀的質量分數,解銀和銅的質量分數確定鋅的質量分數;
(4)①根據題給信息可知乙二醇多一個就讓反應不能繼續;
②根據①得到的聚酯鏈個數計算每條鏈需要乙二酸和乙二醇的個數根據質量守恒計算.
解答 解:(1)①高溫條件下,Fe和H2O反應生成Fe3O4和H2,固體增加的質量為氧元素質量,
設產生氫氣體積為V,
3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2 固體質量增加
89.6L 64g
V 6.88g-5.60g
89.6L:64g=V:(6.88g-5.60g)
V=$\frac{(6.88-5.60)g×89.6L}{64g}$=1.792L=1792mL,
故答案為:1792;
②設剩余鐵的質量為y,
3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2 固體質量增加
168g 64g
5.60g-y 6.88g-5.60g
168g:64g=y:(6.88g-5.60g)
y=5.60g-$\frac{(6.88-5.60)g×168g}{64g}$=2.24g,
根據得失電子守恒,Fe---2FeCl3知,n(FeCl3)=$\frac{\frac{2.24g}{56g/mol}}{1}×2$=0.08mol,
故答案為:0.08;
(2)根據元素守恒知,Nierite含有N元素,且含有Si元素,且Si的質量分數為60%,T中含有Cl元素和Si元素,根據氫原子守恒知,Nierite中僅含N、Si元素,則n(Si):n(N)=$\frac{140×60%}{28}$:$\frac{140×40%}{14}$=3:4,所以恰其化學式為Si3N4,
故Nierite的物質的量=$\frac{35g}{140g/mol}$=0.25mol,
T中含有Cl元素和Si元素,由產物物質的量為0.25molSi3N4和3molHCl得,n(Si):n(Cl)=0.75:3=1:4,可求出T的化學式為SiCl4.
故答案為:Si3N4;SiCl4;
(3)①混合氣體的物質的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,氧氣的物質的量=$\frac{0.084L}{22.4L/mol}$=0.0038mol,
設二氧化氮的物質的量為a,四氧化二氮的物質的量為y,根據原子守恒、轉移電子守恒得
$\left\{\begin{array}{l}{a+b=0.01mol}\\{2a+b=0.0038mol×4}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{a=0.005mol}\\{b=0.005mol}\end{array}\right.$,
則混合氣體的質量=0.005mol×(46g/mol+92g/mol)=0.69g,
M=$\frac{m}{n}$=$\frac{0.69g}{0.01mol}$=69g/mol,
故答案為:69 g/mol;
②合金中其它金屬的質量=2.832g×(1-75%)=0.708g,
假設與硝酸反應的金屬全部是銀,則銀的質量=$\frac{0.0038mol×4}{1}$×108g/mol=1.642g>0.708g,
假設與硝酸反應的金屬全部是銅,則銅的質量=$\frac{0.0038mol×2}{1}$×64g/mol=0.486g<0.708g,
則合金中還有Cu和Ag,
設銀的質量為m,則銅的質量=0.708-m,根據轉移電子守恒得
$\frac{0.708-m}{64g/mol}×2+\frac{m}{108g/mol}=0.0038mol×4$,
m=0.324g,銀的質量分數=$\frac{0.324g}{2.832g}$×100%=11.44%,
則銅的質量分數=25%-11.44%=13.56%,
故答案為:Ag:11.44%;Cu:13.56%;
(4)①乙二醇多一個就讓反應不能繼續,多5個就是5條聚酯鏈,故答案為:5;
②每條聚酯鏈的式量=20個乙二酸+21個乙二醇-40個水=20×90+21×62-40×18=2382,故答案為:2382.
點評 本題考查了物質的量的有關計算,根據物質之間的關系是解本題關鍵,注意原子守恒、轉移電子守恒的運用,注意(3)中合金中其它元素的確定方法,難度中等.


 鷹派教輔銜接教材河北教育出版社系列答案
鷹派教輔銜接教材河北教育出版社系列答案 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:選擇題
| A. | 增大反應物濃度,可增大單位體積內活化分子數,從而使有效碰撞次數增多 | |
| B. | 有氣體參加的化學反應,增大壓強(縮小反應容器的體積),可增大活化分子的百分數,從而使反應速率增大 | |
| C. | 升高溫度能使化學反應速率增大的主要原因是增加了反應物分子中活化分子的百分數 | |
| D. | 催化劑能增大單位體積內活化分子的百分數,從而成千上萬倍地增大化學反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2既是氧化產物又是還原產物 | |
| B. | CuFeS2既是氧化劑又是還原劑 | |
| C. | O2只做氧化劑 | |
| D. | 若有1mol O2參加反應,則反應中有4mol電子轉移 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 負極反應式為Mg-2e-=Mg2+ | |
| B. | 正極反應式為Ag++e-=Ag | |
| C. | 電池放電時Cl-由正極向負極遷移 | |
| D. | 負極會發生副反應Mg+2H2O=Mg(OH)2+H2↑ | |
| E. | 能被KCl溶液激活 | |
| F. | 可用于海上應急照明供電 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba+、NO32-、Cl- | |
| C. | 0.1mol•L-1的FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 ;
; ,
,查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com