
分析 (1)Na2CO3為強堿弱酸鹽,水解呈堿性,在溶液中存在CO32-+H2O?HCO3-+OH-;
(2)CH3COONa溶液中,醋酸根水解,促進水的電離,所以溶液中水電離出的氫氧根離子就是溶液中的氫氧根離子,CH3COOH溶液中,水電離受到抑制,水電離出來的氫離子等于溶液中的氫氧根離子,據此計算;
(3)NaHSO4是強電解質,在水中完全電離出鈉離子、氫離子和硫酸根離子;
(4)FeCl2溶液易被氧氣氧化為氯化鐵,根據三氯化鐵在溶液中存在水解平衡,從平衡移動的角度分析并解答該題;
(5)先根據溶液的pH計算氫氧根離子濃度,再根據c1V1=c2(V1+V2)計算加入的水體積;先根據溶液的pH計算氫氧根離子濃度,再根據c1V1+c2V2=c3(V1+V2)計算加入的氫氧化鈉溶液體積;先計算混合溶液中氫氧根離子濃度,再根據c(OH-)=$\frac{n(堿)-n(酸)}{V(酸)+V(堿)}$計算.
解答 解:(1)Na2CO3為強堿弱酸鹽,水解呈堿性,在溶液中存在CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,因CO32-水解水解顯堿性,且第一步水解大于第一步電離,則離子濃度關系為:c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+),
故答案為:堿;CO32-+H2O?HCO3-+OH-;c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+);
(2)pH=11的CH3COONa溶液中,醋酸根水解,促進水的電離,所以溶液中水電離出的氫氧根離子就是溶液中的氫氧根離子,水電離出來的c(OH-)=$\frac{10{\;}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,在pH=3的CH3COOH溶液中,水電離受到抑制,水電離出來的氫離子等于溶液中的氫氧根離子,水電離出來的c(H+)=$\frac{10{\;}^{-14}}{10{\;}^{-3}}$mol/L=10-11mol/L,
故答案為:10-3;10-11;
(3)NaHSO4是強電解質,在水中完全電離出鈉離子、氫離子和硫酸根離子,電離方程式為:NaHSO4=Na++H++SO42-;
故答案為:NaHSO4=Na++H++SO42-;
(4)FeCl2溶液易被氧氣氧化為氯化鐵,在FeCl3溶液中,Fe3+發生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加熱蒸發,使HCl揮發,破壞平衡,使平衡不斷向右移動,結果生成Fe(OH)3,又由于灼熱使Fe(OH)3分解生成Fe2O3,故答案為:Fe2O3;
(5)pH=12 的NaOH溶液中氫氧根離子濃度是0.01mol/L,pH=11的氫氧化鈉溶液中氫氧根離子濃度是0.001mol/L,設加入水的體積是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L×0.001mol/L,則:V2=$\frac{0.01mol/L×0.1L}{0.001mol/L}$=0.9L=900mL,
pH=12 的NaOH溶液中氫氧根離子濃度是0.01mol/L,pH=11的氫氧化鈉溶液中氫氧根離子濃度是0.001mol/L,pH=10的氫氧化鈉溶液中氫氧根離子濃度是0.0001mol/L,
設加入pH=10的NaOH溶液體積是V2,c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L(0.1+V2),
解得:V2=1L=1000mL,
鹽酸的濃度是0.01mol/L,設加入鹽酸的體積是V,c(OH-)=$\frac{n(堿)-n(酸)}{V(酸)+V(堿)}$=$\frac{0.01mol/L×0.1L-0.01mol/L×VL}{(0.1+V)L}$=0.001mol/L,
解得:V=81.8mL,
故答案為:900;1000;81.8.
點評 本題綜合考查鹽類水解的原理以及影響平衡移動的因素以及酸堿混合的定性判斷及溶液pH的計算,題目難度中等,明確溶液pH的計算方法為解答關鍵,試題側重考查學生達到分析、理解能力及化學計算計算能力.


科目:高中化學 來源: 題型:解答題
| 離子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 處理前濃度(mg/L) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 處理后濃度(mg/L) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
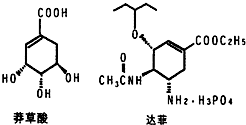 目前世界上已證明“達菲”是治療禽流感和甲型H1N1流感的良方.“達菲”的主要合成原料是我國盛產的莽草酸.從八角茴香中提取的莽草酸經過多次反應和其他工藝制成“達菲”顆粒.下圖是莽草酸和“達菲”有效成分的鍵線式結構(楔形實線、虛線表示基團的立體結構).
目前世界上已證明“達菲”是治療禽流感和甲型H1N1流感的良方.“達菲”的主要合成原料是我國盛產的莽草酸.從八角茴香中提取的莽草酸經過多次反應和其他工藝制成“達菲”顆粒.下圖是莽草酸和“達菲”有效成分的鍵線式結構(楔形實線、虛線表示基團的立體結構).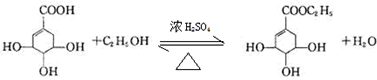 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 單質鐵與鹽酸的反應 Fe+2 H+=Fe2++H2↑ | |
| B. | 氨水跟硫酸發生酸堿中和反應 OH-+H+=H2O | |
| C. | 銅片插入硝酸銀溶液中Cu+Ag+=Cu2++Ag | |
| D. | 碳酸鈣加入醋酸溶液中 CaCO3+2CH3COOH=CO2↑+2CH3COO-+H2O+Ca2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 冶煉原理 | 方法 | |
| A | 2HgO$\frac{\underline{\;加熱\;}}{\;}$2Hg+O2↑ | 熱分解法 |
| B | 2Al2O3(熔融)$\frac{\underline{\;\;\;電解\;\;\;}}{冰晶石}$4Al+3O2↑ | 電解法 |
| C | Cu2S+O2$\frac{\underline{\;高溫\;}}{\;}$2Cu+SO2 | 熱分解法 |
| D | Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2 | 熱還原法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ba(OH)2•8H2O和NH4Cl(s)混合反應 | B. | 生石灰和水的反應 | ||
| C. | 液態水氣化 | D. | 鹽酸與氫氧化鈉溶液的反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com