
 ;
; .
. 分析 A、B、C、D、E、F六種短周期元素,原子序數依次增大.A、E同主族,且E元素原子的核外電子數是A元素原子核內質子數的兩倍,則A為氧元素,E為硫元素;D元素原子最外層電子數是次外層電子數的一半,D元素的原子序數大于氧元素,則D有3個電子層,故最外層電子數為4,故D為硅元素;B、C兩元素原子的最外層電子數之和等于D元素原子的最外層電子數,則B、C最外層電子數之和為4,原子序數B、C大于氧元素,則B、C兩元素不可能為同族元素,最外層電子數為1、3組合,原子序數B小于C,故B為鈉元素,C為鋁元素;C、D兩元素原子最外層電子數之和等于F元素原子的最外層電子數,則F元素原子最外層電子數為3+4=7,故F為氯元素.
解答 A、B、C、D、E、F六種短周期元素,原子序數依次增大.A、E同主族,且E元素原子的核外電子數是A元素原子核內質子數的兩倍,則A為氧元素,E為硫元素;D元素原子最外層電子數是次外層電子數的一半,D元素的原子序數大于氧元素,則D有3個電子層,故最外層電子數為4,故D為硅元素;B、C兩元素原子的最外層電子數之和等于D元素原子的最外層電子數,則B、C最外層電子數之和為4,原子序數B、C大于氧元素,則B、C兩元素不可能為同族元素,最外層電子數為1、3組合,原子序數B小于C,故B為鈉元素,C為鋁元素;C、D兩元素原子最外層電子數之和等于F元素原子的最外層電子數,則F元素原子最外層電子數為3+4=7,故F為氯元素.
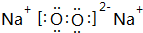
(1)B為鈉元素,F為氯元素,二者形成氯化鈉,由鈉離子與氯離子構成,用電子式表示氯化鈉形成化合物的過程為 ,
,
故答案為: ;
;
(2)A、C兩元素的化合物為氧化鋁,B的氫氧化物為氫氧化鈉,氧化鋁與氫氧化鈉反應生成偏鋁酸鈉與水,反應的離子方程式為:Al2O3+2OH-=2AlO2-+H2O,
故答案為:Al2O3+2OH-=2AlO2-+H2O;
(3)D為硅元素,E為硫元素,非金屬性Si<S,非金屬性越強,氫化物越穩定,D氣態氫化物的穩定性小于E的氣態氫化物的穩定性,
故答案為:小于;
(4)在A中燃燒生成Na2O2,電子式為 ,
,
故答案為: .
.
點評 本題考查性質結構與位置關系應用,推斷元素是關鍵,充分利用核外電子排布規律及結構與位置關系進行推斷,是對學生綜合能力的考查.


 黃岡冠軍課課練系列答案
黃岡冠軍課課練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鋁熱法煉鐵:Fe2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+2Fe | |
| B. | 工業上用NH3制備NO:4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O | |
| C. | 向受酸雨影響的湖泊中噴灑CaCO3粉末:CO32-+2H+$\frac{\underline{\;催化劑\;}}{\;}$H2O+CO2↑ | |
| D. | 過氧化鈉用于呼吸面具中作為氧氣的2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

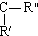 $\stackrel{KMnO4/H+}{→}$RCOOH+
$\stackrel{KMnO4/H+}{→}$RCOOH+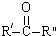
 +H2O
+H2O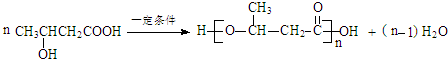 .
. .
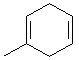
.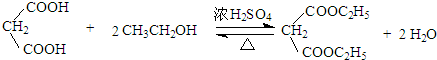 .
. .
.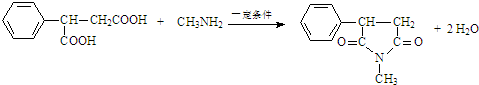 .
.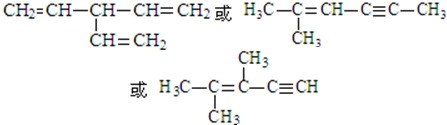 (寫出一種即可).
(寫出一種即可).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | R的最高價氧化物為RO3 | B. | R一定是第ⅦA族元素 | ||
| C. | R的氣態氫化物能燃燒 | D. | R的氣態氫化物易溶于水顯堿性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
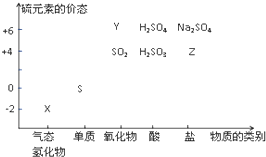 物質的類別和核心元素的化合價是研究物質性質的兩個重要視角.硫及其化合物與價態變化為坐標的二維轉化關系如圖所示
物質的類別和核心元素的化合價是研究物質性質的兩個重要視角.硫及其化合物與價態變化為坐標的二維轉化關系如圖所示 ;其水溶液在空氣中放置易變渾濁,寫出反應的化學方程式2H2S+O2=2S↓+2H2O;
;其水溶液在空氣中放置易變渾濁,寫出反應的化學方程式2H2S+O2=2S↓+2H2O;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | A | B | C | D | E |
| 原子半徑 | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合價 | +1 | +3 | +2 | +6,-2 | -2 |
| A. | 金屬性:C>A | B. | 氫化物的穩定性:H2D<H2E | ||
| C. | 單質與稀鹽酸反應的速率:A<B | D. | 單質的熔點:A>B>E |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 純醋酸中不斷加入水后,導電能力與加水量的關系如圖,請回答有關a、b、c三個點表示的問題:
純醋酸中不斷加入水后,導電能力與加水量的關系如圖,請回答有關a、b、c三個點表示的問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com