
| A. | 反應速率用于衡量化學反應進行的快慢 | |
| B. | 決定反應速率的主要因素是反應物的性質 | |
| C. | 反應速率越大,反應現象就一定越明顯 | |
| D. | 增大反應物的濃度、提高反應溫度都能增大反應速率 |
分析 化學反應速率為單位時間內濃度的變化,可用于衡量化學反應進行的快慢,影響化學反應速率的主要因素為物質的性質,溫度、濃度、催化劑等為外界因素,也是次要原因,一般來說,增大濃度、壓強等,可增大反應速率,以此解答該題.
解答 解:A.化學反應有的快,有的慢,則使用化學反應速率來定量表示化學反應進行的快慢,故A正確;
B.反應物本身的性質是決定反應速率的主要因素,如火藥爆炸、食物腐敗,故B正確;
C.反應速率大,不一定有明顯的現象,如酸堿中和反應,故C錯誤;
D.增大反應物的濃度、提高反應溫度,可增大活化分子的濃度、百分數等,反應速率增大,故D正確.
故選C.
點評 本題考查化學反應速率的因素,為高頻考點,題目難度不大,注意影響化學反應速率的主要原因是物質的性質,為內因,溫度、濃度、壓強、催化劑等為外因.


科目:高中化學 來源: 題型:選擇題
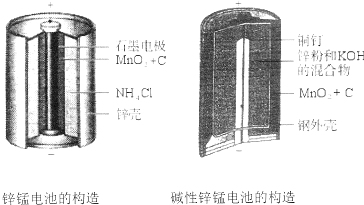
| A. | 該電池反應中二氧化錳起催化作用 | |
| B. | 電池負極反應式為:2MnO2+2e-+2H2O═2MnOOH+2OH- | |
| C. | 當0.1molZn完全反應時,流經電池內部的電子個數為1.204×1023 | |
| D. | 堿性鋅錳電池用鋅粉替代了原鋅錳電池的鋅殼,增大了反應物的接觸面積,加快了反應速率,故放電電流大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉保存在煤油中 | |
| B. | 氫氟酸保存在玻璃試劑瓶中 | |
| C. | 漂白粉必須密封保存 | |
| D. | 氫氧化鈉溶液保存在帶橡膠塞的試劑瓶中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 俄國化學家門捷列夫于1869年發表了第一張元素周期表 | |
| B. | 現代化學常利用原子光譜的特征譜線來測定分子的結構 | |
| C. | DNA雙螺旋的兩個螺旋鏈是用氫鍵相結合的 | |
| D. | 區分晶體和非晶體最可靠的科學方法是X-射線衍射實驗 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 g H2和1 g O2 | |
| B. | 5.6 L N2(標準狀況)和22 g CO2 | |
| C. | 9 g H2O(非標準狀況)和11.2 L(標準狀況)Cl2 | |
| D. | 22.4 L H2(標準狀況)和0.1 mol N2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 中子數為20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的電離方程式:HClO=H++ClO- | |
| C. | Na+的結構示意圖: | |
| D. | 赤鐵礦的主要成分:Fe3O4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
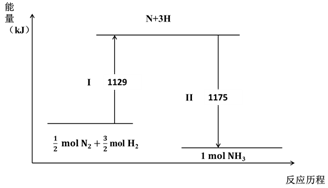
| A. | Ⅰ過程中破壞的均為非極性鍵 | |
| B. | Ⅰ過程吸收能量,II過程放出能量 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-44 kJ•mol-1 | |
| D. | 1mol N2(g)與3 mol H2(g)所具有的總能量比2 mol NH3(g) 所具有的總能量高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3OH的標準燃燒熱為△H=-192.9 kJ•mol-1 | |
| B. | 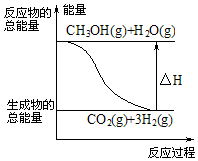 反應①中的能量變化如圖所示 | |
| C. | CH3OH轉變成H2的過程一定要吸收能量 | |
| D. | 根據②推知反應:CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com