
【題目】已知元素的電負性和原子半徑一樣,也是元素的基本性質。下表給出14種元素的電負性:
元素 | AL | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
電負性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
試結合元素周期律相關知識完成下列問題。
(1)根據上表給出的數據,可推知元素的電負性具有的變化規律是__________ (從電負性與結構的關系考慮)。
(2)請預測Br與I元素電負性的大小關系:_________ 。
(3)經驗規律告訴我們:當成鍵的兩原子相應元素的電負性差值大于1.7時,一般為離子鍵,而小于1.7時,一般為共價鍵。試推斷![]() 中化學鍵的類型是 ___________
中化學鍵的類型是 ___________
(4)預測元素周期表中電負性最小的元素是_____ (放射性元素除外)。
【答案】同周期元素隨核電荷數的遞增,元素電負性依次增大,同主族元素隨核電荷數的遞增,元素電負性依次減小 Br>I 共價鍵 Cs
【解析】
(1)結合表格中的數據,從周期和族兩個方面總結規律;
(2)根據電負性變化規律分析;
(3)Cl和Al的電負性之差為1.5,小于1.7,故AlCl3中的化學鍵為共價鍵。
(4)電負性較小的元素位于元素周期表的左下方。
(1)由表中數據可知,第二周期元素從Li~F,隨著原子序數的遞增,元素的電負性逐漸增大,第三周期元素從Na~S,隨著原子序數的遞增,元素的電負性也逐漸增大,并呈周期性變化;同主族元素,元素隨核電荷數的遞增,元素電負性依次減小;
(2)根據電負性變化規律,同主族元素,元素隨核電荷數的遞增,元素電負性依次減小Br的電負性大于I的電負性;
(3)當成鍵的兩原子相應元素的電負性差值大于1.7時,一般為離子鍵,而小于1.7時,一般為共價鍵。結合表格數據,Cl和Al的電負性之差為1.5,小于1.7,故AlCl3中的化學鍵為共價鍵;
(4)電負性較小的元素位于元素周期表的左下方,放射性元素除外,電負性最小的元素是Cs。


科目:高中化學 來源: 題型:
【題目】按要求填空。
(1)![]() 的核外電子排布式:________________________ 。
的核外電子排布式:________________________ 。
(2)![]() 的價電子排布式:________________________ 。
的價電子排布式:________________________ 。
(3)![]() 的電子式:________________________ 。
的電子式:________________________ 。
(4)![]() 的價電子軌道表示式: ________________________ 。
的價電子軌道表示式: ________________________ 。
(5)![]() 的原子結構示意圖: ________________________ 。
的原子結構示意圖: ________________________ 。
(6)第四周期中最外層只有1個電子的所有基態原子的簡化電子排布式:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在T℃下,向裝有5mL0.005mol.L-1FeCl3溶液的試管中加入5mL0.01mol·L-1KSCN溶液,發生如下反應:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,溶液呈血紅色。下列敘述正確的是( )
Fe(SCN)3+3KCl,溶液呈血紅色。下列敘述正確的是( )
A.升高溫度,逆反應速率減小
B.加入Fe2(SO4)3固體,溶液血紅色加深
C.加入KCl固體,溶液血紅色加深
D.增大壓強,溶液血紅色加深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗裝置的說法中正確的是

A.用圖1裝置可用于氣體的發生、干燥和收集,如銅屑與稀硝酸反應制備NO
B.用圖2裝置制備Fe(OH)2并能較長時間觀察其顏色
C.用圖3裝置可以驗證FeCl3對H2O2分解反應有催化作用
D.用圖4裝置測量Cu與濃硝酸反應產生氣體的體積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t ℃時,兩種碳酸鹽MCO3(M分別為A和B兩種離子)的沉淀溶解平衡曲線如圖所示。已知:pM=-lg c(M2+),p(CO32-)=-lg c(CO32-)。ACO3比BCO3溶解度更大。(不考慮陰陽離子的水解)。下列說法正確的是

A.線b表示BCO3的溶解平衡曲線
B.該溫度下,向ACO3的飽和溶液中加入Na2CO3溶液,一定能產生沉淀
C.t ℃時,ACO3(s)+B2+(aq)![]() BCO3(s)+A2+(aq)平衡常數K=10 0.9
BCO3(s)+A2+(aq)平衡常數K=10 0.9
D.向0.1 L 1 mol/L的BCl2溶液中加入Na2CO3固體,當加入Na2CO3固體的質量為116.6 g時,B2+離子恰好沉淀完全(當B2+離子濃度為10-5 mol/L時認為沉淀完全)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國某科研團隊以軟錳礦(主要成分是MnO2,含有SiO2、Fe2O3等少量雜質)為主要原料,制取高純碳酸錳,工藝流程如下圖:
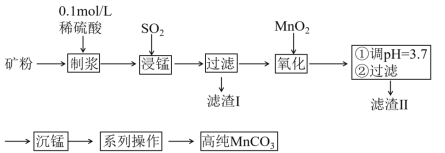
(1)對礦石進行粉粹的目的是_______;
(2)濾渣Ⅰ、Ⅱ分別為________、________;
(3)采用1%稀硫酸而不采用水混合礦粉制漿的原因是_________;不采用較濃H2SO4的原因是______;不直接采用H2SO4浸錳的原因是___________。
(4)浸錳的離子方程式為____________;
(5)“系列操作”為過濾、_________、干燥。
(6)取所得的高純MnCO311.7g溶于足量的鹽酸中,將產生的氣體用足量的Ba(OH)2濃溶液吸收,得到白色沉淀19.7g,則所得產品的純度為________%(保留一位小數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】位于不同主族的四種短周期元素甲、乙、丙、丁,其原子序數依次增大,原子半徑r(丁)>r(乙)>r(丙)>r(甲)。四種元素中,只有一種為金屬元素,乙和丙原子的最外層電子數之和為丁原子的最外層電子數的3倍。據此推斷,下述正確的是
A.簡單氫化物的沸點:乙>丙
B.由甲、乙兩元素組成的化合物溶于水呈堿性
C.丙和丁兩元素的最高價氧化物的水化物之間能發生反應
D.由甲和丙兩元素組成的分子,不可能含非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是
A.1 mol·L-1AlCl3溶液中含有的Al3+數目小于NA
B.標準狀況下,11 g 3H216O中含有的質子數目為6NA
C.1 mol Li2O和Na2O2的混合物中含有的離子總數大于3NA
D.常溫常壓下,4.6 g NO2所含的氮原子數目為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用 NA 表示阿伏加德羅常數,下列說法正確的是
A.用氫氧燃料電池電解飽和食鹽水得到 0.4mol NaOH,在燃料電池的負極上消耗氧氣分子數為 0.1 NA
B.2 mol H3O+中含有的電子數為 20 NA
C.密閉容器中 1 mol N2(g)與 3 mol H2 (g)反應制備氨氣,形成 6 NA 個 N-H 鍵
D.32 g N2H4中含有的共用電子對數為6 NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com