

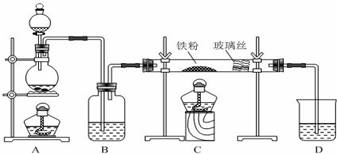
分析 A中圓度燒瓶在加熱條件下可提供水蒸氣,B在加熱條件下,鐵與水蒸氣反應生成四氧化三鐵和氫氣,D為干燥裝置,E中生成的氫氣和氧化銅在加熱條件下反應生成銅和水,可用KSCN檢驗鐵離子,氫氣密度比空氣小,可用肥皂液檢驗氫氣,以此解答該題.
解答 解:(1)裝置B中鐵粉與水蒸氣在高溫下發生反應生成四氧化三鐵和氫氣,反應的化學方程式為:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,
故答案為:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
(2)裝置B鐵與水蒸氣反應生成的氫氣,經堿石灰干燥后加入裝置E,氧化鐵與氫氣加熱發生反應生成了鐵和水,所以反應的現象為:紅色的粉末變成黑色,管壁產生水珠,
故答案為:紅色的粉末變成黑色,管壁產生水珠;
(3)檢驗三價鐵離子的方法為:取少量濾液,滴入幾滴硫氰化鉀溶液,觀察溶液是否變紅色,
故答案為:取少量濾液于試管中,滴入幾滴KSCN溶液,觀察溶液是否變紅色;
(4)氫氣密度比空氣小,可用肥皂液檢驗氫氣,觀察是否有肥皂泡生成,故答案為:插入肥皂液中觀察是否有肥皂泡生成.
點評 本題考查了鐵及其化合物的性質實驗,題目難度不大,注意掌握鐵與水蒸氣反應原理,試題側重對學生能力的培養和訓練,有利于培養學生規范嚴謹的實驗設計、操作能力.


科目:高中化學 來源: 題型:選擇題

| A. | 銅作負極 | B. | 鋅作正極 | ||
| C. | 電子由銅經導線流向鋅 | D. | 鋅片上的反應為:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
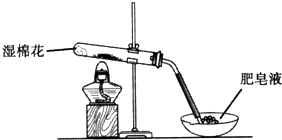 某探究小組采用如圖所示裝置進行Fe粉與水蒸氣的反應.
某探究小組采用如圖所示裝置進行Fe粉與水蒸氣的反應.| 步驟 | 操作 | 甲組現象 | 乙組現象 |
| 1 | 取黑色粉末加入稀鹽酸 | 溶解,無氣泡 | 溶解,無氣泡 |
| 2 | 取步驟1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步驟1中溶液,滴加KSCN溶液 | 變紅 | 無現象 |
| 4 | 向步驟3溶液中滴加新制氯水 | 紅色褪去 | 先變紅,后褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙酸乙酯是重要的有機物,某化學興趣小組對乙酸乙酯的制取進行探究活動.
乙酸乙酯是重要的有機物,某化學興趣小組對乙酸乙酯的制取進行探究活動.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
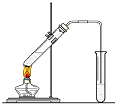 在實驗室我們用如圖所示的裝置制取乙酸乙酯.回答下列問題:
在實驗室我們用如圖所示的裝置制取乙酸乙酯.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
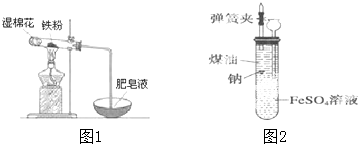 鐵是日常生活中用途最廣、用量最大的金屬材料.
鐵是日常生活中用途最廣、用量最大的金屬材料.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com