解答:
解:A、B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大,A元素的核外電子數和電子層數相等,也是宇宙中最豐富的元素,A為H元素;
B元素原子的核外p電子數比s電子數少1,B有2個電子層,為1s
22s
22p
3,故B為N元素;由C原子的第一至第四電離能數據可知,第三電離能劇增,故C表現+2價,處于ⅡA族,原子序數大于N元素,故C為Mg元素;D處于第三周期,D原子核外所有p軌道全滿或半滿,最外層排布為3s
23p
3,故D為P元素;E處于第三周期,E元素的主族序數與周期數的差為4,E處于第ⅦA族,故E為Cl元素;F是前四周期中電負性最小的元素,F為第四周期元素,故F為K元素,G在第四周期周期表的第7列,G為Mn元素;H元素原子價電子排布式為3d
104s
1,H為Cu元素.
(1)F為9號元素,核外電子數為9,基態原子的核外電子排布式為1S
22S
22P
5,PCl
3中P原子孤電子對數為1,成3個σ鍵,則為sp
3雜化,故答案為:1S
22S
22P
5;sp
3;
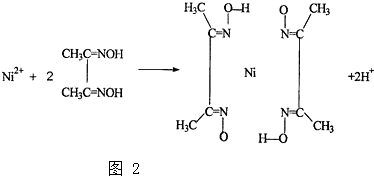
(2)BA
5為離子化合物,則為NH
4H,其電子式為

;
H、A、B三種元素會形成一種配合物的陽離子,其溶液顯深藍色,則為Cu離子溶于氨水形成Cu(NH
3)
42+溶液,其中配離子的結構簡式為

,
故答案為:

;

;
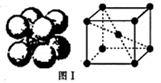
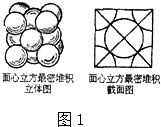
(3)根據F晶體的晶胞可知,為體心立方,晶胞中F原子數目=1+8×
=2,故晶胞質量=2×
g,若設該晶胞的密度為ag?cm
-3,則晶胞體積=
=
cm
3,則晶胞棱長=
cm,令F原子的半徑為r cm,晶胞體對角線上的3個F原子相鄰,則:(4r)
2=3(
)
2解得r=
,
故答案為:
;
(4)CuH和氯氣反應生成氯化銅和氯化氫氣體,6.5gCuH的物質的量為
=0.1mol,故該反應的熱化學方程式為2CuH(s)+3Cl
2(g)=2CuCl
2 (s)+2HCl(g)△H=-20aKJ/mol;故答案為:2CuH(s)+3Cl
2(g)=2CuCl
2 (s)+2HCl(g)△H=-20aKJ/mol;
+1價的Cu被氧化為+2價,生成CuCl2
(5)將CMg
3N
2 加入HCl的水溶液中反應生成二種鹽氯化鎂和氯化銨,反應方程式為Mg
3N
2+8HCl=3MgCl
2+2NH
4Cl;
將濃度為a mol/LNH
3溶液和0.1mol?L
-1HCl溶液等體積混合后溶液呈中性,依據溶液中電荷守恒c(NH
4+)+c(H
+)=c(OH
-)+c(Cl
-),溶液呈中性說明c(H
+)=c(OH
-)=10
-7mol/L;c(NH
4+)=c(Cl
-)=0.005mol/L,則NH
3溶液的電離常數=
=
=
.
故答案為:.
.

 現有8種元素,它們的原子序數依次增大,其中A、B、C、D、E為短周期主族元素,F、G、H為第四周期元素.請根據下列相關信息,回答問題.
現有8種元素,它們的原子序數依次增大,其中A、B、C、D、E為短周期主族元素,F、G、H為第四周期元素.請根據下列相關信息,回答問題. ;
; ,
, ;
; ;
;

 (1)現有以下幾種物質::①晶體二氧化硅②干冰③五氯化磷④金剛石⑤過氧化鈉⑥冰⑦碳化硅⑧白磷;請用編號填寫:通過非極性鍵形成原子晶體的是
(1)現有以下幾種物質::①晶體二氧化硅②干冰③五氯化磷④金剛石⑤過氧化鈉⑥冰⑦碳化硅⑧白磷;請用編號填寫:通過非極性鍵形成原子晶體的是