
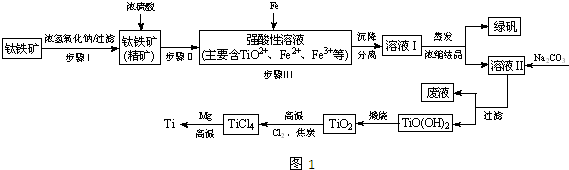
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔點/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸點/℃ | 136.4 | 1090 | 1412 | 3287 |


 品學雙優卷系列答案
品學雙優卷系列答案 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:

| 催化劑 |
| △ |
查看答案和解析>>
科目:高中化學 來源: 題型:
 某溫度下,在2L密閉容器中X、Y、Z三種物質(均為氣態)間進行反應,其物質的量隨時間的變化曲線如圖.依圖回答:
某溫度下,在2L密閉容器中X、Y、Z三種物質(均為氣態)間進行反應,其物質的量隨時間的變化曲線如圖.依圖回答:查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
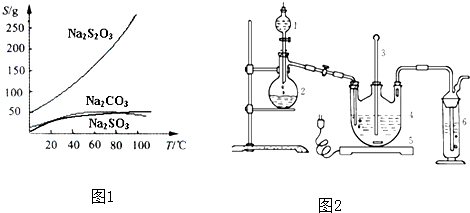
| ||
| 活性炭脫色 |
| 并保溫 |
| 操作① |
| 蒸發濃縮 |
| 冷卻晶體 |
| 操作② |
| 編號 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3標準溶液的體積/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 今有某一種堿金屬的兩種碳酸鹽和堿土金屬(第ⅡA族)的一種不溶性碳酸鹽組成的混合物,取其7.560g與過量鹽酸完全反應,放出CO2體積為1.344L(標況下),另取等質量的原混合物,加水攪拌,可濾出不溶性鹽1.420g.
今有某一種堿金屬的兩種碳酸鹽和堿土金屬(第ⅡA族)的一種不溶性碳酸鹽組成的混合物,取其7.560g與過量鹽酸完全反應,放出CO2體積為1.344L(標況下),另取等質量的原混合物,加水攪拌,可濾出不溶性鹽1.420g.查看答案和解析>>
科目:高中化學 來源: 題型:
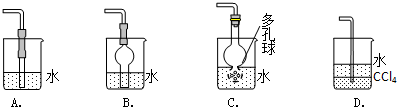
 用如圖所示的收集裝置收集氨氣時,由于氣流略強使得在試管底部形成氣旋,導致氨氣與空氣混合而不能收集到純氨氣.現在有一小團棉花,請問將棉花放在試管那個位置可以阻止氣旋?請說明理由.
用如圖所示的收集裝置收集氨氣時,由于氣流略強使得在試管底部形成氣旋,導致氨氣與空氣混合而不能收集到純氨氣.現在有一小團棉花,請問將棉花放在試管那個位置可以阻止氣旋?請說明理由.查看答案和解析>>
科目:高中化學 來源: 題型:
| 溫度/°C | K1 | K2 |
| 500 | 1.00 | 3.5 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
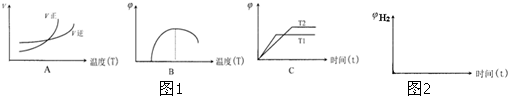
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、化合反應一定是放熱反應 |
| B、乙二醇和丙三醇都易溶于水和乙醇 |
| C、犧牲陽極的陰極保護法是利用了電解原理 |
| D、相同條件下,CuSO4溶液比FeCl3溶液使H2O2分解速率更快 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com